中学理科の現役教員けいが「中2理科の化学分野-元素と原子、周期表–」を、どこよりも分かりやすく解説します。
この記事を読むと、要点をギュッとまとめた分かりやすいまとめノートにそって学習できるため、効率的な学習ができます。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。化学分野を基礎から学びたい方は、ぜひ参考にしてください。
- 元素とは原子の種類のこと|中2理科 化学
- 【周期表とは】原子番号順の表|中2理科 化学
- 元素記号の覚え方
- 元素記号は歌で覚える
- 【水素とは】H|中2理科 化学
- 【ヘリウムとは】He|中2理科 化学
- 【リチウムとは】Li|中2理科 化学
- 【炭素とは】C|中2理科 化学
- 【窒素とは】N|中2理科 化学
- 【酸素とは】O|中2理科 化学
- 【ナトリウムとは】Na|中2理科 化学
- 【マグネシウムとは】Mg|中2理科 化学
- 【アルミニウムとは】Al|中2理科 化学
- 【硫黄とは】S|中2理科 化学
- 【塩素とは】Cl|中2理科 化学
- 【カリウムとは】K|中2理科 化学
- 【カルシウムとは】Ca|中2理科 化学
- 【鉄とは】Fe|中2理科 化学
- 【銅とは】Cu|中2理科 化学
- 【亜鉛とは】Zn|中2理科 化学
- 【銀とは】Ag|中2理科 化学
- 【バリウムとは】Ba|中2理科 化学
- 【水銀とは】Hg|中2理科 化学
- 【ニホニウムとは】Nh|中2理科 化学
- 【まとめノート】元素記号を整理して覚えよう|中2理科 化学
元素とは原子の種類のこと|中2理科 化学
元素は、物質を構成する原子の種類です。
2024年8月時点で、118種類の元素が発見されています。
元素の知識は、化学分野の重要な基礎知識です。
本章では、元素について、次のような内容を解説します。
本章で学べる内容
- 元素と原子のちがい
- 元素記号と周期表
- テストに出やすい元素記号一覧
元素と原子のちがい
原子は、物質をつくっている小さな粒子です。
原子の特徴は次の3点です。
原子の特徴
- 化学変化でそれ以上分けられない
- 化学変化で新しくできたりしないし、種類が変わったりしないし、なくなったりしない
- 種類によって、質量や大きさが決まっている
例として、水素原子について考えてみましょう。
水素原子1コは、それ以上分けられません。
水素原子1コを、何もないところから化学変化によってつくり出すことはできません。
水素原子1コの質量は、0.00000000000000000000000167g(1.67×10のマイナス24乗)だと決まっています。
原子は、化学変化や状態変化によって、分かれたり、種類が変わったりはしません。
しかし、核融合や核分裂などによって、分かれたり、種類が変わったりします。
例えば、水素どうしが核融合して、ヘリウムになるのです。
中学理科では、核融合や核分裂について学ばないため、原子の性質をかんたんに分かりやすく表現しています。
元素記号と周期表
元素記号は、原子の種類を表す記号です。原子の種類は、118種類あります。
元素記号の表し方は次のとおりです。
元素記号の表し方
- アルファベットで表す
- 1文字の元素は、大文字だけで表す
例;水素 → H - 2文字の元素は、1文字目が大文字、2文字目は小文字
例;ヘリウム → He
周期表は、118種類ある原子を並べた表です。
テストに出やすい元素記号一覧
高校入試や中学理科の定期テストでよく出る元素、元素記号は次のとおりです。
| 元素名 | 元素記号 | 英語 | 由来 |
|---|---|---|---|
| 水素(すいそ) | H | Hydrogen | |
| ヘリウム | He | Helium | |
| リチウム | Li | Lithium | |
| 炭素(たんそ) | C | Carbon | |
| 窒素(ちっそ) | N | Nitrogen | |
| 酸素(さんそ) | O | Oxygen | |
| ナトリウム | Na | Sodium | Natron |
| マグネシウム | Mg | Magnesium | |
| アルミニウム | Al | Aluminium | |
| 硫黄(いおう) | S | Suffer | |
| 塩素(えんそ) | Cl | Chlorine | |
| カリウム | K | Potassium | Kalium |
| カルシウム | Ca | Calsium | |
| 鉄(てつ) | Fe | Iron | Ferrum |
| 銅(どう) | Cu | Copper | Cyprus |
| 亜鉛(あえん) | Zn | Zinc | |
| 銀(ぎん) | Ag | Silver | Argentium |
| バリウム | Ba | Barium | |
| 水銀(すいぎん) | Hg | Mercury | Hydrargyrum |
| ニホニウム | Nh | Nihonium |
【周期表とは】原子番号順の表|中2理科 化学
周期表は、118種類ある原子を、原子番号の順に並べた表です(下図▼)。
![]() ※周期表の高画質版(1920*1080)をダウンロードしたい方はこちらからどうぞ▼
※周期表の高画質版(1920*1080)をダウンロードしたい方はこちらからどうぞ▼
周期表の縦の列を「族」といいます。縦の列は性質が似ています。
周期表の横の行を「周期」と言います。
原子番号は、 陽子の数をもとに決められています。
例えば水素の場合、陽子は1個あるため、原子番号が1です。
また、ヘリウムの場合、陽子が2個あり、原子番号が2になります。
元素記号の覚え方
上図は、中学理科でよく出る元素記号20種を示しています。
結論、次のように覚えると長期記憶に残りやすいです。
元素記号の覚え方
- 元素の写真と元素名、元素記号をよく見て、元素をイメージする
- 何回も紙に書き、声に出し、暗記する
- 1週間後、チェックする
- その1週間後、再びチェックする
- その1カ月後、もう一度チェックする
上記のように、頭に刻み込むように覚えましょう。
なお、元素記号の覚え方として、高校化学ではよく次のように教わります。
『水兵リーベぼくの船七曲がりシップスクラークか』
| 覚え歌 | 元素記号 | 元素名 |
| すい | H | 水素 |
| へい | He | ヘリウム |
| リー | Li | リチウム |
| ベ | Be | ベリリウム |
| ぼ | B | ホウ素 |
| く | C | 炭素 |
| の | N | 窒素 |
| O | 酸素 | |
| ふ | F | フッ素 |
| ね | Ne | ネオン |
| なな | Na | ナトリウム |
| まがり | Mg | マグネシウム |
| Al | アルミニウム | |
| シッ | Si | ケイ素 |
| プ | P | リン |
| ス | S | 硫黄 |
| クラー | Cl | 塩素 |
| Ar | アルゴン | |
| ク | K | カリウム |
| か | Ca | カルシウム |
なお、上記の覚え歌は、中学理科ではあまり出てこない元素が含まれています。
しかも、覚えてほしい元素が入っていないため、中学理科としてはこの覚え歌はおすすめできません。高校入学後、楽しみながら覚えましょう。
元素記号は歌で覚える
元素記号は歌で覚えるのも一つの手です。
私がおすすめしている元素の歌系YouTube動画ベスト3を紹介します。
おすすめ度No.1
Theodore Grayさんによる『元素 (The Elements song in Japanese)』は、美しい画像とともに元素が紹介されています。
おすすめ度No.2
北白川かかぽさんによる『【元素の覚え歌】スイヘイリーベ 〜魔法の呪文〜 (New Version) / covered by 北白川かかぽ【VEE】』も、おすすめです。
この曲はTVアニメ「エレメントハンター」のエンディングテーマ『スイヘイリーベ~魔法の呪文~/かっきー&アッシュポテト』をポップに明るくカバーしたものです。
おすすめ度No.3
櫻坂46 OFFICIAL YouTube CHANNELによる『元素記号のうた』は、若かりし頃の長濱ねるさんが、クセのある踊りで元素を歌っています。
【水素とは】H|中2理科 化学
水素は、宇宙で最も豊富に存在する元素であり、私たちの身のまわりにも様々な形で存在しています。
水素は、その名が示すとおり、水をつくっている元素です。
水素の元素記号
水素の元素記号は、Hです。
水素の英語はHydrogenです。
水素の原子番号は1、第1族第1周期の元素です。
水素の化学式
水素は分子をつくります。
水素の化学式(分子式)はH₂です。
水素の性質
水素は、水をつくっている原子です。
有機物にも、水素が含まれていることが多いです。
水素は、常温ではもっとも軽い無色無臭の気体として存在しています。
太陽では、大量の水素が燃えており、大きなエネルギーを生み出し続けています。
水素を燃料とした自動車(水素自動車)もあり、二酸化炭素を排出しないクリーンな乗り物として、注目されています。
水素は、火をつけると、燃えて熱を出します。
中学理科の実験では、水素の入った試験管に火のついたマッチを近づけると「ポンと音を立てて燃える」という実験をよく行います。燃えた後、水ができるため、試験管の内側がくもります。
中学理科として知っておくべき水素の性質をまとめると、次のようになります。
水素の性質
- 密度が、すべての元素の中で最も小さい
- 水にとけにくい
- 空気中で燃えて水になる
中学理科で学習する、水素の発生方法は次のとおりです。
水素の発生方法
- 亜鉛に、うすい塩酸を加える
- 鉄に、うすい塩酸を加える
- 金属に、うすい塩酸を加える
【中学理科】水素をふくむ化合物
水素をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
水素をふくむ化合物
- 水;H₂O
- 過酸化水素;H₂O₂
- アンモニア;NH₃
- 塩化水素;HCl
- 硫化水素;H₂S
- 酢酸;CH₃COOH
- 硫酸;H₂SO₄
- 硝酸;HNO₃
- 水酸化ナトリウム;NaOH
- 水酸化カリウム;KOH
- 水酸化カルシウム;Ca(OH)₂
- 水酸化バリウム;Ba(OH)₂
- 炭酸水素ナトリウム;NaHCO₃
- メタン;CH₄
水素がかかわる化学反応【中学理科】
水素がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
水素がかかわる化学反応
- 水の電気分解;2H₂O→2H₂+O₂
- 塩酸の電気分解;2HCl→H₂+Cl₂
【ヘリウムとは】He|中2理科 化学
![]()
ヘリウムは、宇宙で水素に次いで2番目に多い元素です。
日本語の元素名である「ヘリウム」は、ギリシャ語の太陽を意味する「ヘリオス」に由来しています。
ヘリウムの元素記号
ヘリウムの元素記号は、Heです。
ヘリウムの英語はHeliumです。
ヘリウムの原子番号は2、第18族第1周期の元素です(希ガス元素)
ヘリウムの化学式
ヘリウムは分子をつくりません。
ヘリウムの化学式はHeです。
ヘリウムの性質
ヘリウムは、常温では無色無臭の気体で、空気よりもはるかに軽いです。
ヘリウムは、非常に安定した元素で、他の元素と反応しにくいため、化合物を作ることがほとんどありません。
非常に低い温度まで冷却しても、液体状態を保つことができるという性質も持っています。
【リチウムとは】Li|中2理科 化学
リチウムは、現代社会において非常に重要な役割を担っている元素の1つです。
スマートフォンや電気自動車に使われるリチウムイオン電池の原料として知られています。
リチウムの元素記号
リチウムの元素記号は、Liです。
リチウムの英語は、Lithiumです。
リチウムの原子番号は3、第1族第2周期の元素です(金属元素)。
リチウムの化学式
リチウムは分子をつくりません。
リチウムの化学式はLiです。
リチウムの性質
リチウムは、常温では銀白色のやわらかい金属として存在しています。
リチウムは、すべての金属元素の中で最も軽く、非常に柔らかい金属です。
深赤色(しんせきしょく)の炎色反応を示します。
リチウムは、電池の材料として非常に適しています。私たちの身のまわりにある多くの電子機器に、リチウムイオン電池が使われています。
リチウムイオン電池が使われている例
- スマートフォン
- ノートパソコン
- 電気自動車
【炭素とは】C|中2理科 化学
炭素は、地球上の生命にとって重要な元素であり、私たちの身のまわりにも数多く存在しています。
ダイヤモンドや鉛筆の芯、そして私たち自身の体の中にも、炭素は含まれています。
炭素の元素記号
炭素の元素記号は、Cです。
炭素の英語はCarbonです。ラテン語の木炭Carboが由来となっています。
炭素の原子番号は6、第14族第2周期、非金属元素のひとつです。
炭素の化学式
炭素は分子をつくりません。
炭素の化学式はCです。
炭素の性質
炭素は、多様な性質を生かして、様々な分野で利用されています。
炭素の利用分野
- 燃料
- 材料
- 高分子(プラスチックなどのこと)
- 生命
1.燃料としての炭素
石炭、石油、天然ガスなど、多くの化石燃料は、炭素を主成分としています。
2.材料としての炭素
ダイヤモンドや黒鉛は、炭素でつくられています。
ダイヤモンドは世界で最もかたい物質として知られ、指輪などの装飾品に使われています。また、ダイヤモンドカッターなどの研磨剤としても利用されています。
また、黒鉛(グラファイト)は、鉛筆の芯や電池の電極に使われています。
3.高分子としての炭素
プラスチック、ゴムなど、多くの高分子材料には炭素が含まれています。
4.生命としての炭素
生物の体を構成するタンパク質や糖質などには、すべて炭素が含まれています。
中学理科で学ぶ有機物の性質は、次のとおりです。
有機物とは
- 炭素をふくむ物質
- 燃えると二酸化炭素と水ができる
- 有機物の例;砂糖、かたくり粉、木、ろう、紙、エタノール、プラスチック、ゴム
【中学理科】炭素をふくむ化合物
炭素をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
炭素をふくむ化合物
- 二酸化炭素;CO₂
- 酢酸;CH₃COOH
- 炭酸水素ナトリウム;NaHCO₃
- 炭酸ナトリウム;Na₂CO₃
- メタン;CH₄
【中学理科】炭素がかかわる化学反応
炭素がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
炭素がかかわる化学反応
- 炭素+酸素→二酸化炭素
C+O₂→CO₂ - 酸化銅+炭素→銅+二酸化炭素
2CuO+C→2Cu+CO₂ - マグネシウム+二酸化炭素→酸化マグネシウム+炭素
2Mg+CO₂→2MgO+C
【窒素とは】N|中2理科 化学
窒素は、空気の約78%を占める、私たちにとって最も身近な元素の一つです。
この記事を読んでいる、今、この瞬間にもあなたは窒素を吸い込んでいます。
窒素の元素記号
窒素の元素記号は、Nです。
窒素の英語はNitrogenです。ラテン語の硝石Nitrumが由来となっています。
窒素の原子番号は7、第15族第2周期の元素です。
窒素の化学式
窒素は分子をつくります。
窒素の化学式はN₂です。
窒素の性質
窒素は、常温では無色無臭の気体として存在しています。
窒素は、鮮度を保つ目的で、食品に封入されています。理由は「他の物質と結びつきにくいため」です。
中学理科では、アミノ酸に窒素が含まれているため、細胞呼吸のあとアンモニアができることを学習します。
【中学理科】窒素をふくむ化合物
窒素をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
窒素をふくむ化合物
- アンモニア;NH₃
- 塩化アンモニウム;NH₄Cl
- 硝酸;HNO₃
- 硝酸カリウム;KNO₃
【酸素とは】O|中2理科 化学

酸素は、空気中に約21%含まれており、私たちが呼吸をして生きていくために必要不可欠な元素です。
酸素は地球でもっとも多く存在する元素です。
酸素の元素記号
酸素の元素記号は、Oです。
酸素の英語は、Oxygenです。ギリシャ語のOxysが由来となっています。
酸素の原子番号は8、第16族第2周期の元素です。
酸素の化学式
酸素は分子をつくります。
酸素の化学式はO₂です。
酸素の性質
酸素は常温では、無色無臭の気体です。空気より少し重いです。
酸素は、非常に反応性の高い元素です。
多くの物質と結びついて酸化物をつくります。その際に熱を出すことがあります。
この性質は、燃焼を助けるはたらきをするため、酸素は燃焼を助ける気体として知られています。
生物が呼吸をする際に、酸素を取り込んでエネルギーを生み出しています。細胞1つひとつにも酸素が必要で、細胞呼吸が行われます。


中学理科において、覚えてほしい酸素の性質をまとめると、次のようになります。
酸素の性質
- 密度が空気より大きい
- 水にとけにくい
- ほかのものを燃やすはたらきがある
- 酸素の入った試験管に、火のついた線香を近づけると、激しく燃える
中学理科における、酸素の発生方法は次のとおりです。
酸素の発生方法
- 植物による光合成
- 二酸化マンガンにうすい過酸化水素水を加える
- 過炭酸ナトリウムに約60℃の湯を加える
- ふろがま洗浄剤に約60℃の湯を加える
- ダイコンおろしにオキシドールを加える
【中学理科】酸素をふくむ化合物
酸素をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
酸素をふくむ化合物
- 水;H₂O
- 酸化銅;CuO
- 酸化銀;Ag₂O
- 酸化マグネシウム;MgO
- 二酸化炭素;CO₂
- 炭酸水素ナトリウム;NaHCO₃
- 酢酸;CH₃COOH
- 硫酸;H₂SO₄
- 硫酸銅;CuSO₄
- 硫酸バリウム;BaSO₄
- 硫酸亜鉛;ZnSO₄
- 硫酸マグネシウム;MgSO₄
- 硝酸;HNO₃
- 硝酸カリウム;KNO₃
- 硝酸銀;AgNO₃
- 水酸化ナトリウム;NaOH
- 水酸化カリウム;KOH
- 水酸化カルシウム;Ca(OH)₂
- 水酸化バリウム;Ba(OH)₂
【中学理科】酸素がかかわる化学反応
酸素がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
酸素がかかわる化学反応一覧
- 水→水素+酸素
2H₂O→2H₂+O₂ - 水素+酸素→水
2H₂+O₂→2H₂O - 酸化銀→銀+酸素
2Ag₂O→4Ag+O₂ - 過酸化水素水→酸素+水
2H₂O₂→2H₂O+O₂ - 炭素+酸素→二酸化炭素
C+O₂→CO₂ - 銅+酸素→酸化銅
2Cu+O₂→2CuO - マグネシウム+酸素→酸化マグネシウム
2Mg+O₂→2MgO
【ナトリウムとは】Na|中2理科 化学

ナトリウムは、食塩の主成分である塩化ナトリウムに含まれる金属です。
ナトリウムは、ヒトが生きるために欠かせない必須ミネラルの一種で、体内で合成することができないため、食事などから取らないといけません。
ナトリウムの元素記号
ナトリウムの元素記号は、Naです。
ナトリウムの英語はSodiumです。ラテン語の炭酸ナトリウムであるNatronが由来となっています。
ナトリウムの原子番号は11、第1族第3周期の元素です。
ナトリウムの化学式
ナトリウムは分子をつくりません。
ナトリウムの化学式は、Naです。
ナトリウムの性質
ナトリウムは常温で、銀白色の光沢をもつ柔らかい金属です。
食塩である塩化ナトリウムや、重曹である炭酸水素ナトリウムに含まれており、私たちの生活に欠かせない元素です。
【中学理科】ナトリウムをふくむ化合物
ナトリウムをふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
ナトリウムをふくむ化合物
- 塩化ナトリウム;NaCl【食塩】
- 水酸化ナトリウム;NaOH【苛性ソーダ】
- 炭酸水素ナトリウム;NaHCO₃【重曹】
- 炭酸ナトリウム;Na₂CO₃【炭酸ソーダ】
【中学理科】ナトリウムがかかわる化学反応
ナトリウムがかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
ナトリウムがかかわる化学反応式
- 炭酸水素ナトリウム→炭酸ナトリウム+二酸化炭素+水
NaHCO₃→Na₂CO₃+CO₂+H₂O - 塩酸+水酸化ナトリウム→塩化ナトリウム+水
HCl+NaOH→NaCl+H₂O
【マグネシウムとは】Mg|中2理科 化学

マグネシウムは、花火の光を明るくする成分として知られています。
マグネシウムの元素記号
マグネシウムの元素記号は、Mgです。
マグネシウムの英語はMagnesiumです。鉱石の産出地であるマグネシアMagnesia地方が由来となっています。
マグネシウムの原子番号は12、第2族第3周期の元素です。
マグネシウムの化学式
マグネシウムは分子をつくりません。
マグネシウムの化学式はMgです。
マグネシウムの性質
マグネシウムは、常温で銀白色のやわらかく軽い金属です。軽いため、軽量合金として使われています。
熱や電気をよく通します(電気伝導性が高い)。
また、マグネシウムはヒトの健康維持に欠かせないミネラルとしても知られています。
アオサやゴマなどに多く含まれており、骨や葉のはたらきをサポートしたり、腸内の水分量を増やしたりしてくれます。
便秘のときに、酸化マグネシウムのサプリを飲むとよいとされています。
【中学理科】マグネシウムをふくむ化合物
マグネシウムをふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
マグネシウムをふくむ化合物
- 酸化マグネシウム;MgO
- 硫酸マグネシウム;MgSO₄
【中学理科】マグネシウムがかかわる化学反応
マグネシウムがかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
マグネシウムがかかわる化学反応式
- マグネシウム+酸素→酸化マグネシウム
2Mg+O₂→2MgO - マグネシウム+二酸化炭素→酸化マグネシウム+炭素
2Mg+CO₂→2MgO+C
【アルミニウムとは】Al|中2理科 化学

アルミニウムは、缶ジュースやアルミホイルに使われている身近な金属です。
アルミニウムの元素記号
アルミニウムの元素記号は、Alです。
アルミニウムの英語はAluminiumです。
アルミニウムの原子番号は13、第13族第3周期の元素です。
アルミニウムの化学式
アルミニウムは分子をつくりません。
アルミニウムの化学式は、Alです。
アルミニウムの性質
アルミニウムは、常温で銀白色の軽い金属です。熱や電気をよく通します。
日本の1円玉は、アルミニウム100%でできています。
アルミニウムは、アルミ缶やアルミホイルとして、日常生活に欠かせない金属です。
【硫黄とは】S|中2理科 化学

硫黄は、温泉のにおいの元となる元素です。
硫黄は、火薬や医薬品としても、使われています。
硫黄の元素記号
硫黄の元素記号は、Sです。
硫黄の英語はSufferです。ラテン語の硫黄Sulpurが由来となっています。
硫黄の原子番号は16、第16族第3周期の元素です。
硫黄の化学式
硫黄は分子をつくりません。
硫黄の化学式は、Sです。
硫黄の性質
硫黄は、常温で非金属のもろい黄色い結晶として存在します。
硫黄が含まれる代表的な化合物は硫酸です。
硫酸は塩酸よりも強い酸性の水溶液として、中学理科でもよく使われます。
硫黄そのものは無臭ですが、硫黄をふくむ化合物には特有のにおいをもつものが多いです。
【中学理科】硫黄をふくむ化合物
硫黄をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
硫黄をふくむ化合物
- 硫化水素:H₂S
- 硫化鉄:FeS
- 硫化銅:CuS
- 硫酸:H₂SO₄
- 硫酸銅:CuSO₄
- 硫酸バリウム:BaSO₄
- 硫酸亜鉛:ZnSO₄
- 硫酸マグネシウム:MgSO₄
【中学理科】硫黄がかかわる化学反応
硫黄がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
硫黄がかかわる化学反応式
- 鉄+硫黄→硫化鉄
Fe+S→FeS - 銅+硫黄→硫化銅
Cu+S→CuS
【塩素とは】Cl|中2理科 化学

塩素は、プールの消毒に使われる元素です。
塩素の元素記号
塩素の元素記号は、Clです。
塩素の英語はChlorineです。塩素の色である黄緑色を意味するラテン語Chlorusが由来です。
塩素の原子番号は17、第17族第3周期の元素です。
塩素の化学式
塩素は分子をつくります。
塩素の化学式(分子式)は、Cl₂です。
塩素の性質
塩素は、常温で黄緑色の刺激臭のある有毒な気体です。プールの消毒のにおいとして有名です。
塩素について、中学理科では次の2つの性質を覚えるといいでしょう。
塩素の性質
- 消毒(しょうどく)
- 漂白(ひょうはく)
漂白剤に「混ぜるな危険」と書かれていますが、なぜでしょう。
この理由は、有毒な気体である塩素が発生するからです。
水でしめらせたリトマス紙を、気体の塩素に近づけるとどうなるでしょう。
正解は「リトマス紙の色が消える」です。
リトマス紙と言えば、赤色や青色と答えたくなるのですが、塩素の漂白作用によって、色が消えてしまうのです。
また、塩素は水にとかすと、酸性を示します。
塩素が含まれている酸性の水溶液として、塩酸があります。
塩酸は、塩化水素HClの溶けた水溶液です。
【中学理科】塩素をふくむ化合物
塩素をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
塩素をふくむ化合物
- 塩化ナトリウム:NaCl
- 塩化水素:HCl
- 塩化銅:CuCl₂
【中学理科】塩素がかかわる化学反応
塩素がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
塩素がかかわる化学反応式
- 塩化水素→水素+塩素
2HCl→H₂+Cl₂ - 塩化銅→銅+塩素
CuCl₂→Cu+Cl₂ - 銅+塩素→塩化銅
Cu+Cl₂→CuCl₂
【カリウムとは】K|中2理科 化学

カリウムは、バナナに多く含まれるミネラルです。生物にとって、重要な元素の1つです。
名探偵コナンでたまに出てくる青酸カリ(シアン化カリウム)にも、カリウムが含まれています。
カリウムの元素記号
カリウムの元素記号は、Kです。
カリウムの英語はPotassiumです。ラテン語Kaliumが由来です。
カリウムの原子番号は19、第1族第4周期の元素です(アルカリ金属元素のひとつ)。
カリウムの化学式
カリウムは分子をつくりません。
カリウムの化学式は、Kです。
カリウムの性質
カリウムは、常温で銀白色の柔らかい金属です。
【中学理科】カリウムをふくむ化合物
カリウムをふくむ化合物のうち、中学理科で出てくるものは水酸化カリウムだけです。
水酸化カリウムの化学式はKOHです。
【カルシウムとは】Ca|中2理科 化学
![]()

カルシウムは、骨や歯の成分として知られています。
カルシウムの元素記号
カルシウムの元素記号は、Caです。
カルシウムの英語はCalciumです。塩素の色である黄緑色を意味するラテン語Chlorusが由来です。
カルシウムの原子番号は20、第2族第4周期の元素です。
カルシウムの化学式
カルシウムは分子をつくりません。
カルシウムの化学式は、Caです。
カルシウムの性質
カルシウムは、常温で銀白色の金属です。
カルシウムは、硬水に含まれていることでも知られています。
【中学理科】カルシウムをふくむ化合物
カルシウムをふくむ化合物のうち、中学理科で出てくるものは水酸化カルシウムだけです。
水酸化カルシウムの化学式は、Ca(OH)₂です。
【鉄とは】Fe|中2理科 化学

鉄は、私たちの身のまわりにある多くの製品に使われている金属です。
鉄の元素記号
鉄の元素記号は、Feです。
鉄の英語はIronです。強固を意味するラテン語Ferrumが由来です。
鉄の原子番号は26、第8族第4周期の元素です。
鉄の化学式
鉄は分子をつくりません。
鉄の化学式は、Feです。
鉄の性質
鉄は、常温で灰白色(かいはくしょく)の光沢のある金属です。
鉄は磁石につく性質があります。なお、どの金属にも磁石がつくわけではありません。
また、スチールウールは鉄でできています。
【中学理科】鉄をふくむ化合物
鉄をふくむ化合物のうち、中学理科で出てくるものは硫化鉄だけです。
硫化鉄の化学式は、FeSです。
【中学理科】鉄がかかわる化学反応
鉄がかかわる化学反応のうち、中学理科で出てくるものは、次の1つだけです。
鉄+硫黄→硫化鉄
Fe+S→FeS
【銅とは】Cu|中2理科 化学

銅は、電気を通しやすく、熱伝導率も高いため、電気製品や配管に使われています。
- 電気伝導性
- 熱伝導性
銅の元素記号
銅の元素記号は、Cuです。
銅の英語はCopperです。銅鉱山のなかで有名な地中海のキプロス島Cyprusが由来です。
銅の原子番号は29、第11族第4周期の元素です。
銅の化学式
銅は分子をつくりません。
銅の化学式は、Cuです。
銅の性質
銅は、常温で赤色の光沢のある金属です。
電気や熱をよく通します。
日本の10円玉は、銅が95%でできています(のこりは、亜鉛4%とスズ1%です)。
ちなみに、5円玉もほとんど銅でできています。5円玉の素材割合は銅60%、亜鉛40%です。
さらに、50円玉や100円玉、500円玉も銅が75%ふくまれています。
【中学理科】銅をふくむ化合物
銅をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
銅をふくむ化合物
- 塩化銅:CuCl
- 酸化銅:CuO
- 硫化銅:CuS
- 硫酸銅:CuSO₄
【中学理科】銅がかかわる化学反応
塩素がかかわる化学反応のうち、中学理科で出てくるものは、次のとおりです。
塩素がかかわる化学反応式
- 塩化銅→銅+塩素
CuCl₂→Cu+Cl₂ - 銅+塩素→塩化銅
Cu+Cl₂→CuCl₂ - 銅+硫黄→硫化銅
Cu+S→CuS - 銅+酸素→酸化銅
2Cu+O₂→2CuO - 酸化銅+炭素→銅+二酸化炭素
2CuO+C→2Cu+CO₂ - 酸化銅+水素→銅+水
CuO+H₂→Cu+H₂O
【亜鉛とは】Zn|中2理科 化学

亜鉛は、乾電池の材料として使われています。
亜鉛の元素記号
亜鉛の元素記号は、Znです。
亜鉛の英語はZincです。とがったものを意味するドイツ語Zinkeが由来です。
亜鉛の原子番号は30、第12族第4周期の元素です。
亜鉛の化学式
亜鉛は分子をつくりません。
亜鉛の化学式は、Znです。
亜鉛の性質
亜鉛は、常温で青みをおびた銀白色の金属です。
5円硬貨や10円硬貨にもふくまれていたり、乾電池につかわれていたりと、私たちの生活に欠かせません。
【中学理科】亜鉛をふくむ化合物
亜鉛をふくむ化合物のうち、中学理科で出てくるものは硫酸亜鉛だけです。
硫酸亜鉛の化学式は、ZnSO₄です。
【銀とは】Ag|中2理科 化学

銀は、光沢があり、変色しにくいことから、装飾品や食器に使われます。
銀の元素記号
銀の元素記号は、Agです。
銀の英語はsilverです。明るいという意味のラテン語Argentumが由来です。
銀の原子番号は47、第11族第5周期の元素です(銅族元素のひとつ)。
銀の化学式
銀は分子をつくりません。
銀の化学式は、Agです。
銀の性質
銀は、常温で銀白色の金属です。電気伝導性と熱伝導性が金属のなかで最もすぐれている。
銀の光沢を利用した高級食器や指輪などがつくられます。
銀色なので勘違いされやすい100円玉は、実は銀は全く含まれていません。銅とニッケルを合わせてつくられています。
【中学理科】銀をふくむ化合物
銀をふくむ化合物のうち、中学理科で出てくるものは次のとおりです。
銀をふくむ化合物
- 酸化銀:Ag₂O
- 硝酸銀:AgNO₃
【中学理科】銀がかかわる化学反応
銀がかかわる化学反応のうち、中学理科で出てくるものは、次の1つだけです。
酸化銀→銀+酸素
2Ag₂O→4Ag+O₂
【バリウムとは】Ba|中2理科 化学
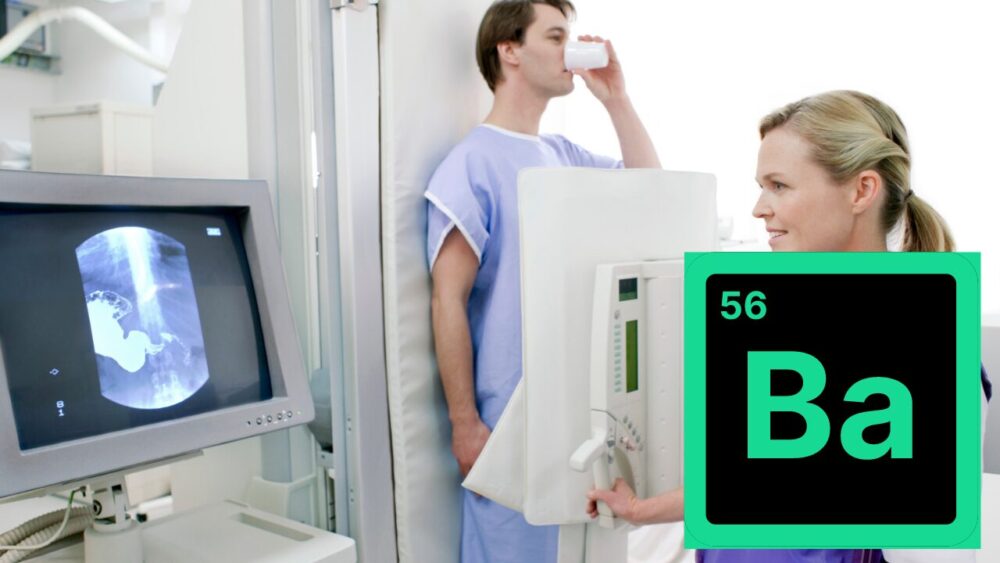
バリウムは、花火の緑色の光を出す成分として知られています。
また、バリウム化合物(硫酸バリウムなど)は、レントゲン検査の造影剤として使われるため、健康診断などの際に飲む方がいます。
バリウムの元素記号
バリウムの元素記号は、Baです。
バリウムの英語はBariumです。「重い」を意味するギリシャ語barysが由来です。
バリウムの原子番号は56、第2族第6周期の元素です。
バリウムの化学式
バリウムは分子をつくりません。
バリウムの化学式は、Baです。
バリウムの性質
バリウムは、常温で銀白色のやわらかい金属です。
黄緑色の変色反応を示します。
【中学理科】バリウムをふくむ化合物
バリウムをふくむ化合物のうち、中学理科で出てくるものは水酸化バリウムだけです。
水酸化バリウムの化学式は、Ba(OH)₂です。
【水銀とは】Hg|中2理科 化学

水銀は、かつて水銀温度計や水銀灯(蛍光灯)など、生活に欠かせない元素でしたが、環境に悪いためどんどん利用がなくなっています。
水銀の元素記号
水銀の元素記号は、Hgです。
水銀の英語はmercuryです。「水の銀」を意味するギリシャ語に由来するラテン語Hydrargyrumを略してHgとしています。
水銀の原子番号は80、第12族第6周期の元素です。
水銀の化学式
水銀は分子をつくりません。
水銀の化学式は、Hgです。
水銀の性質
水銀は金属のなかで、唯一の常温で液体の金属です。
銀白色で光沢をもちます。
毒性がつよく、水俣病の原因としても有名です。
【ニホニウムとは】Nh|中2理科 化学

ニホニウムは、日本の理化学研究所の森田浩介教授のグループに発見された元素です。
亜鉛(原子番号30)の原子核を、ビスマス(原子番号83)に衝突させることでつくりだし、2016年に名前が正式決定しました。
ニホニウムの元素記号
ニホニウムの元素記号は、Nhです。
ニホニウムの英語はNihoniumです。もちろん、Nihon(日本)が由来です。
ニホニウムの原子番号は113、第13族第7周期の元素です。
ニホニウムの性質
ニホニウムは、人工的に合成された放射性元素です。
【まとめノート】元素記号を整理して覚えよう|中2理科 化学
本記事では、元素記号と原子、中学理科で覚えるべき元素について学習しました。
この記事におけるポイントを、ぎゅっとまとめたノートが下図です▼

原子の性質は、次の3つです。
原子の性質
- 化学変化でそれ以上分けられない
- 化学変化で新しくできたりしないし、種類が変わったりしないし、なくなったりしない
- 種類によって、質量や大きさが決まっている
元素と原子のちがいは、次のとおりです。
- 原子は、最小の粒子。
→原子が結びついて分子になるものもある。 - 元素は、原子の種類。
周期表は、下図のように元素を並べた表です▼
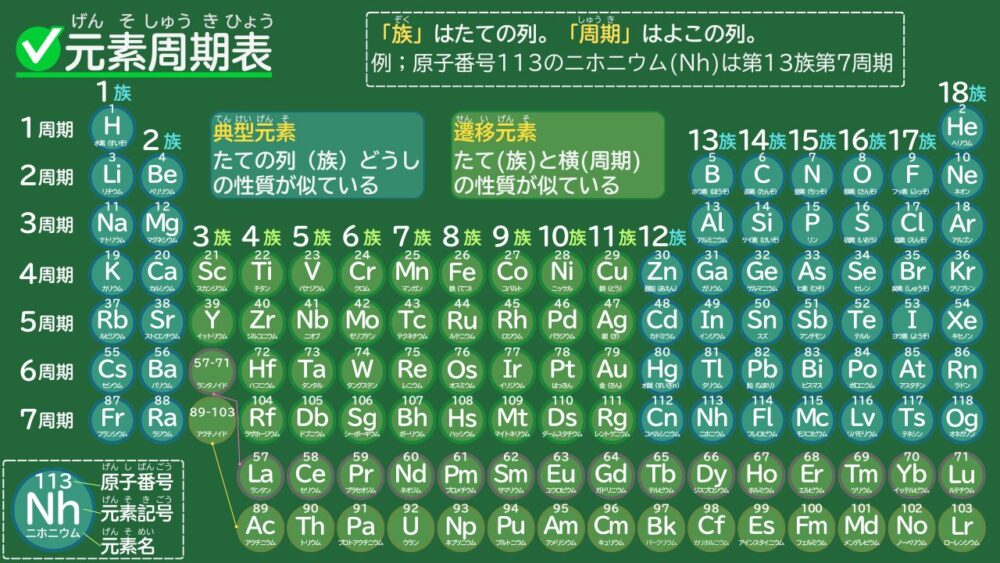
以上、中学2年生の生物分野『原子と元素、周期表』についての解説でした。
この記事が、皆さんの理解のお役に立てれば幸いです。






