この記事では、中学理科の現役教員けいが、化学反応が苦手な方でも理解できるように、中2理科の化学分野『発熱反応と吸熱反応』を解説します。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。発熱反応と吸熱反応についてキホンから学びたい方は、ぜひ最後までお読みください。
発熱反応と吸熱反応のちがい|中2理科 化学
本章で学べる内容は、次のとおりです。
本章で学べる内容
- 【発熱反応】まわりに熱を出す
- 【吸熱反応】まわりから熱を吸い取る
化学変化のなかには、熱を発生させたり、熱を吸収したりする反応があります。
ヒトの発熱は「体温を下げるため」だという話は聞いたことがあるでしょう。
ヒトの発熱の話から「発熱反応は温度が下がる」と勘違いしている方がいます。勘違いしないためのポイントは『物質の温度をはかる温度計はどうなるか』ということです。
発熱反応と吸熱反応は、下のように「まわり」の温度に注目します。
発熱反応と吸熱反応のポイント
- 熱を発生すると、まわりの温度が上がる
- 熱を吸収すると、まわりの温度が下がる
上記のざっくりポイントを理解したうえで、次の解説をお読みください。
【発熱反応】まわりに熱を出す
発熱反応は、周囲に熱を出し、まわりの温度を上げる化学変化です。
温度計ではかると、反応前よりも温度が高くなります。
【吸熱反応】まわりから熱を吸い取る
吸熱反応は、周囲から熱を吸収し、まわりの温度を下げる化学変化です。
温度計ではかると、反応前よりも温度が低くなります。
【実験】化学かいろ|中2理科 化学
本章で学べる内容は、次のとおりです。
本章で学べる内容
- 化学かいろのしくみ
- 化学かいろ実験の手順
- 化学かいろ実験の注意点
- 化学かいろ実験の結果
- 化学かいろ実験の考察
- 化学かいろ実験の化学反応式
化学かいろのしくみ
化学かいろとは「使い捨てカイロ」のことです。
使い捨てカイロでは、鉄粉が酸化するときに出る熱を利用しています。
通常、鉄が酸化する(さびる)のは、おだやかに時間をかけて進むため、利用できるほどの熱は発生しません。
化学かいろ(使い捨てカイロ)では、多くの熱をすばやく発生させるために、次の物質を用います。
化学かいろの熱を出すための物質
- 塩化ナトリウム(食塩)…鉄の酸化を速める
- 活性炭(炭素)…酸素を取り込む
- 水…鉄の酸化(さびる)を促進する
- バーミキュライト…水を保水する
化学かいろ実験の手順
化学かいろ実験の手順は、次のとおりです。
化学かいろ実験の手順
- 袋に鉄粉と活性炭を入れる
- 塩化ナトリウム水溶液をしみこませた紙を袋に入れる
- よく振り混ぜてから温度をはかる
化学かいろ実験の結果
化学かいろ実験の結果は、次のとおりです。
化学かいろ実験の結果
- 温度が上がる
化学かいろ実験の考察
化学かいろ実験の考察は、次のとおりです。
化学かいろ実験の考察
- 鉄が酸素と結びつく(酸化する)ときに、発熱反応を起こしたことが分かる
化学かいろ実験の化学反応式
化学かいろ実験の熱を考えた化学反応式は、次のとおりです。
化学かいろ実験の熱を考えた化学反応式
鉄 + 酸素 → 酸化鉄 + 熱
中学理科では覚える必要はありませんが、知りたい方のために掲載しておきます。
覚える化学かいろ(使い捨てカイロ)の化学反応式は、次のとおりです。
化学かいろの化学反応式
4Fe+3O₂+6H₂O→4Fe(OH)₃
鉄+酸素+水→水酸化第二鉄
【実験】簡易冷却パック|中2理科 化学
本章で学べる内容は、次のとおりです。
本章で学べる内容
- 簡易冷却パックのしくみ
- 簡易冷却パック実験の手順
- 簡易冷却パック実験の注意点
- 簡易冷却パック実験の結果
- 簡易冷却パック実験の考察
- 簡易冷却パック実験の化学反応式
簡易冷却パックのしくみ
冷却パックとは使い捨ての「瞬間冷却剤」のことです。
叩くだけですぐ冷たくなるため、アウトドアやスポーツなどでよく用いられます。
市販の瞬間冷却剤では、硝酸アンモニウムと尿素が水に反応したときの吸熱反応を利用しています。
中学校での理科実験では、炭酸水素ナトリウム(重曹)とクエン酸を材料にすることが多いです。
炭酸水素ナトリウムの化学式はNaHCO₃で、弱アルカリ性を示します。
化学反応により二酸化炭素を発生するため、掃除や料理に使われています。
クエン酸はレモンや梅干しなどに含まれています。料理の添加物としても、いろいろな商品につかわれています。
簡易冷却パック実験の手順
簡易冷却パック実験の手順は、次のとおりです。
簡易冷却パック実験の手順
- 袋に炭酸水素ナトリウム、クエン酸を入れる
- 水を袋に入れる
- よく振り混ぜてから温度をはかる
簡易冷却パック実験の注意点
簡易冷却パック実験の注意点と理由は、次のとおりです。
簡易冷却パック実験の注意点と理由
袋を密閉してはいけない
[理由]気体が発生するため
簡易冷却パック実験の結果
簡易冷却パック実験の結果は、次のとおりです。
簡易冷却パック実験の結果
- 温度が下がる
- 気体が発生する
簡易冷却パック実験の考察
簡易冷却パック実験の考察は、次のとおりです。
簡易冷却パック実験の考察
- 炭酸水素ナトリウムとクエン酸が気体を発生するときに、吸熱反応を起こしたことが分かる
- 発生した気体は、二酸化炭素である
簡易冷却パック実験の化学反応式
簡易冷却パック実験の熱を考えた化学反応式は、次のとおりです。
簡易冷却パック実験の熱を考えた化学反応式
炭酸水素ナトリウム+クエン酸+熱→二酸化炭素+…
中学理科では、めったに出題されないですが、知りたい方のために解説しておきます。
簡易冷却パックの化学反応式は、次のとおりです。
簡易冷却パックの化学反応式
3NaHCO₃+C₆H₈O₇
→3CO₂+3H₂O+Na₃(C₃H₅O(COO)₃)
炭酸水素ナトリウム+クエン酸
→二酸化炭素+水+クエン酸三ナトリウム
【実験】アンモニアの発生|中2理科 化学
本章では、アンモニアの発生実験について『熱』をテーマに解説します。
中学1年で学習するアンモニアの発生実験では、試験管を用いて下方置換法で集めました。中学2年で学習するアンモニア発生実験では、ビーカーを用います。
本章では、中学2年で学習するビーカーでアンモニアを発生させる実験を解説します。学べる内容は、次のとおりです。
本章で学べる内容
- アンモニアの発生実験の手順
- アンモニアの発生実験の注意点
- アンモニアの発生実験の結果
- アンモニアの発生実験の考察
- アンモニアの発生実験の化学反応式
アンモニアの発生の手順
アンモニアの発生実験の手順は、次のとおりです。
アンモニアの発生実験の手順
- 水酸化バリウムと塩化アンモニウムを、ふれあわないようにビーカーに入れる
- ぬれたろ紙に穴をあけて、ビーカーにかぶせる
- あけた穴に温度計をさしこみ、反応前の温度をはかっておく
- ぬれたろ紙を少しめくってガラス棒をさしこみ、よく混ぜ、反応後の温度をはかる
アンモニアの発生の注意点
アンモニアの発生実験の注意点と理由は、次のとおりです。
アンモニアの発生の注意点と理由
- ろ紙は、水でぬらしておく
[理由]発生するアンモニアを、ぬれたろ紙に吸着させるため - 発生するアンモニアを、深く吸い込まないようにする
[理由]アンモニアは有毒だから
アンモニアの発生の結果
アンモニアの発生実験の結果は、次のとおりです。
アンモニアの発生実験の結果
- 温度が下がる
アンモニアの発生の考察
アンモニアの発生実験の考察は、次のとおりです。
アンモニアの発生実験の考察
- 水酸化バリウムと塩化アンモニウムの化学変化が、吸熱反応であることが分かる
アンモニアの発生の化学反応式
アンモニアの発生の化学反応式は、次のとおりです。
アンモニアの発生の化学反応式
2NH₄Cl + Ca(OH)₂ → CaCl₂ + 2H₂O + 2NH₃
塩化アンモニウム + 水酸化カルシウム → 塩化カルシウム + 水 + アンモニア
なお、アンモニアの発生の化学反応式は、応用的な内容のため、余裕のある方のみ覚えるといいでしょう。
中学理科で出てくる発熱反応一覧|中2理科 化学
中学理科で登場する、代表的な発熱反応は次のとおりです。
中学理科でよく出る発熱反応
- 鉄の酸化
- 鉄と硫黄の反応
- ろうや木など有機物の燃焼
- 石油や天然ガスなど、有機物の燃料の燃焼
- 酸化カルシウムと水の反応
本章では、上記の発熱反応について、詳しく解説します。
鉄の酸化
鉄は酸化するときに発熱反応を起こします。
なお、空気中の鉄が、おだやかに酸化する(さびる)ときは、まとまった熱を取り出せません。
化学かいろ(使い捨てカイロ)のように、塩化ナトリウムや活性炭、水などで反応を速めて、大きな熱を出させるのです。
詳しくは、前節「【実験】化学かいろ|中2理科 化学」をお読みください。
鉄の酸化と熱の関係をかんたんに表すと、次のように示せます。
鉄の酸化と熱の関係
鉄+酸素→酸化鉄+熱
鉄と硫黄の反応
鉄と硫黄が結びつき、硫化鉄ができる化学変化は、発熱反応です。
鉄と硫黄の化学変化の実験のうち、次のような手順があります。
手順
試験管に入れた混合物の上部を加熱する。赤く色が変わり始めたら加熱をやめ、変化のようすを観察する
上記の手順の結果、化学変化が起こると、ガスバーナーの加熱をやめても化学変化が続くようすが観察されます。
加熱をやめても化学変化が続くのは、反応によって熱や光が発生するためです。
詳しくは、下の記事が参考になります。
≫中2理科|化合物ができる化学反応を現役教員が分かりやすく解説! #水 #塩化銅 #硫化鉄 #硫化銅
鉄と硫黄から硫化鉄ができる化学変化と熱の関係を、かんたんに表すと次のように示せます。
鉄と硫黄から硫化鉄ができる化学変化と熱の関係
鉄+硫黄→硫化鉄+熱
ろうや木など有機物の燃焼
ろうや木など有機物の燃焼は、発熱反応です。
ろう(ろうそく)や木を燃やすと、燃え尽きるまで燃焼は続きます。つまり、有機物の燃焼は発熱反応だと言えます。
燃焼について、より学習したい方は、次の記事を参考にしてください。
燃焼は、酸化の反応の一つです。
ろうや木などに含まれる炭素が酸化するときに、熱を発生します。
有機物の燃焼と熱の関係をかんたんに表すと、次のように示せます。
有機物の燃焼と熱の関係
有機物+酸素→二酸化炭素+○○+…+熱
石油や天然ガスなど、有機物の燃料の燃焼
石油や天然ガスなど有機物燃料の燃焼は、発熱反応です。
石油や天然ガスは燃やすと、大量の熱や光を出すため燃料として用いられています。つまり、石油などの燃料の燃焼は、発熱反応だと言えます。
酸化カルシウムと水の反応【発熱剤つき弁当】
酸化カルシウムと水の反応は、発熱反応です。加熱式弁当などに用いられています。
発熱剤入り弁当のしくみ
- 弁当の下に、粒状の酸化カルシウム(生石灰とも呼ばれる)と、水入りの袋が入っている
- ひもを引っ張ると、水入りの袋が破れるようになっている
- 水入りの袋が破れると、酸化カルシウムと水が化学反応を起こし、熱を発生する
酸化カルシウムと水の反応と、熱の関係をかんたんに表すと、次のように示せます。
酸化カルシウムと水の反応と熱の関係
酸化カルシウム+水→水酸化カルシウム+熱
中学理科では、下の化学反応式は覚える必要はありませんが、興味のある方のために掲載しておきます。
酸化カルシウムと水の化学反応式
CaO + H₂O → Ca(OH)₂
酸化カルシウム+水→水酸化カルシウム
中学理科で出てくる吸熱反応一覧|中2理科 化学
中学理科で出てくる吸熱反応は、主に次の2つだけです。
中学理科でよく出る吸熱反応
- 炭酸水素ナトリウムとクエン酸と水の反応
- 塩化アンモニウムと水酸化バリウムの反応
発熱反応がたくさんあったのに対して、吸熱反応は2つだけなので、上記の2点は確実に覚えてほしいです。
本章では、上記の化学変化と熱の関係をまとめます。
炭酸水素ナトリウムとクエン酸の反応
炭酸水素ナトリウムとクエン酸の反応は、吸熱反応です。中学理科では、冷却パックとして、よく出題されます。
炭酸水素ナトリウムとクエン酸の反応と熱の関係をかんたんに表すと、次のように示せます。
炭酸水素ナトリウムとクエン酸の反応と熱の関係
炭酸水素ナトリウム+クエン酸+熱→二酸化炭素+…
詳しくは、前章「【実験】簡易冷却パック|中2理科 化学」で解説しています。
塩化アンモニウムと水酸化バリウムの反応
塩化アンモニウムと水酸化バリウムの反応は、吸熱反応です。化学変化により、アンモニアが発生します。
塩化アンモニウムと水酸化バリウムの反応と熱の関係をかんたんに表すと、次のように示せます。
塩化アンモニウムと水酸化バリウムの反応と熱の関係
塩化アンモニウム + 水酸化カルシウム +熱→二酸化炭素+…
詳しくは、前章「【実験】アンモニアの発生|中2理科 化学」で解説しています。
【まとめノート】熱くなるのが発熱、冷たくなるのが吸熱|中2理科 化学
本記事では、中学2年の化学分野で学習する発熱反応と吸熱反応を解説しました。
本記事で、絶対に理解してほしいポイントは次の2点です。
- 【発熱反応】まわりに熱を出す
A + B → C + D + 熱 - 【吸熱反応】まわりから熱を吸い取る
A + B + 熱 → C + D
化学反応と熱の関係は、次のノートのようにまとめるといいでしょう。
![]()

化学かいろ、冷却パック、アンモニアの発生の3つの実験をまとめたノートが下の画像です。
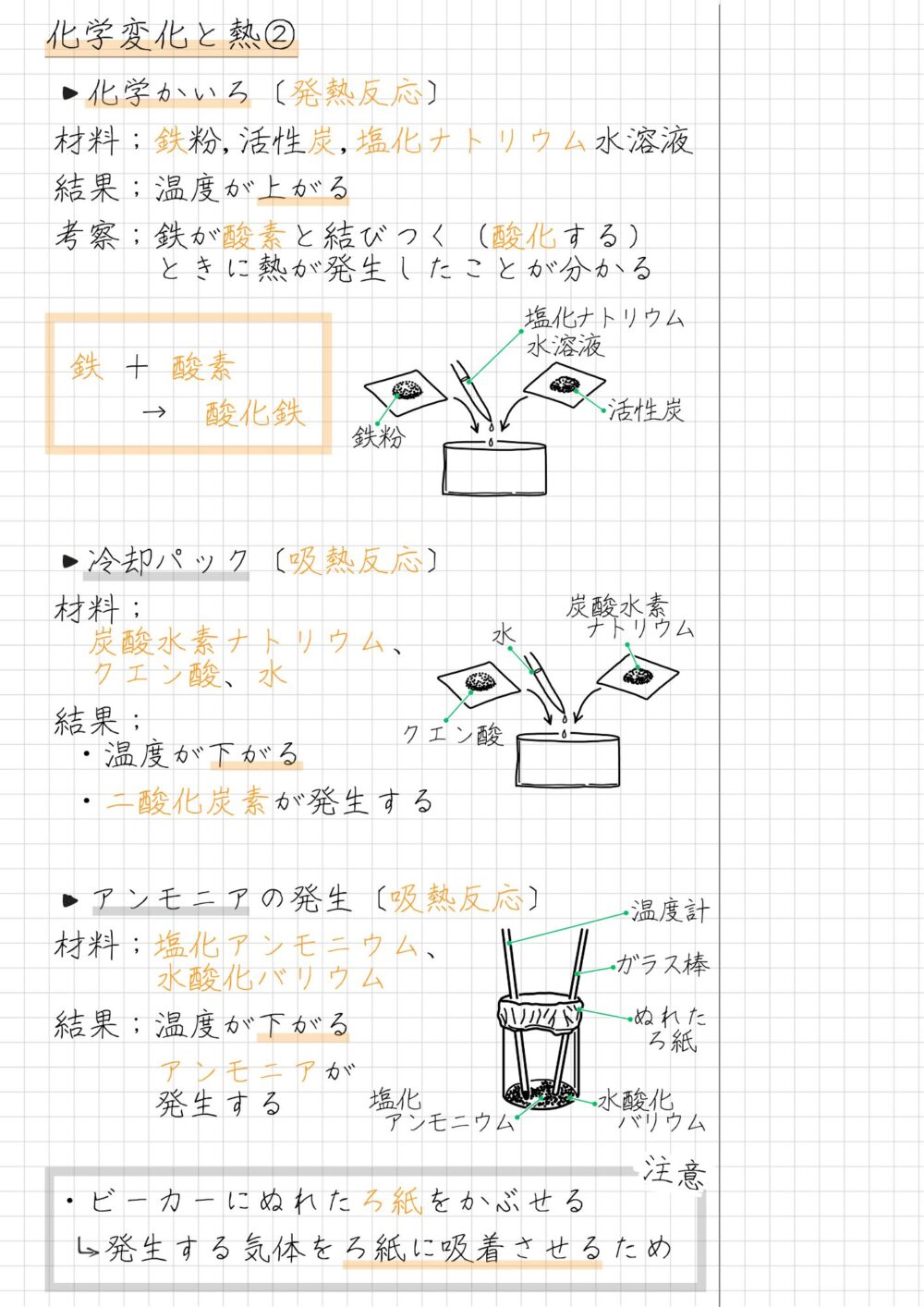
以上、中2化学『発熱反応と吸熱反応』でした。
発熱と関わりがある「燃焼と酸化」について学習したい方は、次の記事を参考にしてください。


発熱反応である硫化鉄ができる化学変化について、学びたい方は、下の記事が参考になるでしょう。








