中学理科の現役教員けいが「中2理科の化学分野-化合物ができる化学反応–」を、超分かりやすく解説します。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。キソから徹底的に学びたい方は、ぜひ最後までお読みください。
結びつく化学変化とは?|中2理科 化学
化学変化(化学反応)とは、もとの物質とは性質の異なる別の物質ができる変化のことです。
化学反応には、物質どうしが結びつく化学反応や、別の物質に分かれる化学反応(分解)などがあります。
中学理科でよく出る化学反応は、次のとおりです。
化学変化(化学反応)まとめ
- 結びつく化学変化【A+B→C】
○酸化;酸素と結びつく
○燃焼;激しく熱や光を出す酸化
・塩素と結びつく(塩化)
・硫黄と結びつく(硫化) - 分かれる化学変化【A→B+C】
○電気分解;電気による物質の分解
○熱分解;熱による物質の分解
・還元;酸素と分かれる
上記の化学変化のうち、本章では、次のように結びつく化学変化を解説します。
本章で学べる内容
- 酸素と結びつく化学変化
- 塩素と結びつく化学変化
- 硫黄と結びつく化学変化
なお、古い教科書では、結びつく化学変化を「化合」と表現していましたが、今の中学理科教育では「化合」という用語をつかいません。
酸素と結びつく化学変化
酸素と結びつく化学変化を酸化と言います。
酸化のうち、激しく熱や光を出しながら反応が進む現象を、燃焼と言います。
中学理科で学習する酸化の化学反応は、主に次の4つです。
酸化の化学反応
- 水素の酸化【燃焼】
2H₂+O₂→2H₂O - 炭素の酸化【燃焼】
C+O₂→CO₂ - 銅の酸化
2Cu+O₂→2CuO - マグネシウムの酸化【燃焼】
2Mg+O₂→2MgO
本記事では、上記の化学反応のうち、酸化の代表として「1.水素の酸化」を次章「【酸化の例】水素と酸素が結びついて水ができる反応」で解説します。
塩素と結びつく化学変化
化学反応の中には、下のように、塩素Clと結びつく変化があります。
塩素と結びつく化学変化
Cu+Cl₂→CuCl₂
なお、塩化銅は電気分解により、銅と塩素に分かれます。詳しくは下の記事を参考にしてください。
硫黄と結びつく化学変化
化学反応の中には、下のように、硫黄Sと結びつく変化があります。
硫黄と結びつく化学変化
- 硫化鉄ができる反応
Fe+S→FeS - 硫化銅ができる反応
Cu+S→CuS
【酸化の例】水素と酸素が結びついて水ができる反応|2H₂+O₂→2H₂O
水素に火のついたマッチを近づけると、音を立てて燃え、水ができます。
なお、水素が燃えるとき、水素は酸素と結びつきます。つまり、水素は酸化した結果、水になるのです。
水素は酸化するとき、激しい光と熱を出しており「燃焼」していると言えます。
本章では、水素が燃えたあとにできる「水」を観察できる実験を解説します。
本章で学べる内容
- 水ができる実験の手順
- 水ができる実験の結果
- 水ができる実験の考察
- 水ができる実験の化学反応式
水ができる実験の手順
水ができる実験の手順は、次のとおりです。
水ができる実験の手順
- 透明な袋に青色の塩化コバルト紙を入れる
- 袋に水素:酸素=2:1の割合で混合して入れる
- 電気花火で点火し、反応のようすを観察する
- 塩化コバルト紙の色の変化を観察する
- 水素のみで、同様の実験を行い、反応のようすや塩化コバルト紙の色の変化を観察する
水ができる反応の結果
本実験における結果は、次のとおりです。
【結果】
水素と酸素の混合気体
- 激しく炎が出たあと、袋がしぼんで中がくもる
- 青色の塩化コバルト紙が赤色に変化する
水素のみ
- 反応が起こらない
- 青色の塩化コバルト紙の色が変化しない
水ができる反応の考察
本実験における考察と理由は、次のとおりです。
考察と理由
【考察】
袋のなかに発生した液体は水である
【理由】
塩化コバルト紙が赤色に変化するから
水ができる反応の化学反応式
水ができる反応の化学反応式は、次のとおりです。
水ができる反応の化学反応式
2H₂ + O₂ → 2H₂O
水素 + 酸素 → 水
本実験において、水素:酸素=2:1の割合の混合気体を用いたのは、1つの水分子ができるには、水素分子が2つ、酸素分子が2つ必要だからです。
水の電気分解の化学反応式は、次のとおりです。
水の電気分解の化学反応式
2H₂O → 2H₂ + O₂
水 → 水素 + 酸素
銅と塩素から塩化銅ができる反応|Cu+Cl₂→CuCl₂
固体の銅と気体の塩素が結びつくと、塩化銅になります。
本章では、塩化銅ができる反応を解説します。
本章で学べる内容
- 塩化銅の性質
- 塩化銅ができる実験の手順
- 塩化銅ができる実験の注意点
- 塩化銅ができる実験の結果
- 塩化銅ができる実験の考察
- 塩化銅ができる実験の化学反応式
塩化銅の性質
塩化銅の化学式はCuCl₂です。
塩化銅は、塩素と銅による化合物です。
塩化銅ができる実験の手順
塩化銅ができる実験の手順は、次のとおりです。
塩化銅ができる実験の手順
- 集気びんに塩素を入れる
- 銅線を加熱する
- 加熱した銅線を、塩素の入った集気びんに入れ、反応のようすを観察する
塩化銅ができる実験の結果
塩化銅ができる実験の結果は、次のとおりです。
【結果】
- 激しく反応が起こる
- 赤色だった銅線の色が変化し黒くなる
塩化銅ができる実験の考察
塩化銅ができる実験の考察は、次のとおりです。
【考察】
- 反応後に生じた物質は塩化銅である
塩化銅ができる反応の化学反応式
塩化銅ができる反応の化学反応式は、次のとおりです。
塩化銅ができる反応の化学反応式
Cu + Cl₂ → CuCl₂
銅 + 塩素 → 塩化銅
塩化銅ができる反応の化学反応式と、真逆の反応を示すのは塩化銅の電気分解です。
塩化銅の電気分解の化学反応式は、次のとおりです。
塩化銅の電気分解
CuCl₂ → Cu + Cl₂
塩化銅 → 銅 + 塩素
鉄と硫黄から硫化鉄ができる反応|Fe+S→FeS
非金属の硫黄と金属の鉄が結びつくと、硫化鉄になります。
本章では、硫化鉄ができる反応を解説します。
本章で学べる内容
- 硫化鉄の性質
- 硫化鉄ができる実験の手順
- 硫化鉄ができる実験の注意点
- 硫化鉄ができる実験の結果
- 硫化鉄ができる実験の考察
- 硫化鉄ができる実験の化学反応式
硫化鉄の性質
硫化鉄は分子をつくらない物質で、化学式がFeSです。
硫化鉄は鉄と硫黄による化合物で、灰黒色の結晶です。
硫化鉄は塩酸にとけると、硫化水素を発生します。
硫化鉄ができる実験の手順
硫化鉄ができる実験の手順は、次のとおりです。
硫化鉄ができる実験の手順
- 鉄と硫黄を混ぜ合わせる
- 鉄と硫黄の混合物を、試験管Aに4分の1の量を入れ、試験管Bに4分の3の量を入れる
- 試験管Bに入れた混合物の上部を加熱する。赤く色が変わり始めたら加熱をやめ、変化のようすを観察する
- 試験管A(加熱していない混合物)と試験管B(加熱後の物質)の色などを観察する
- 試験管A(加熱していない混合物)と試験管B(加熱後の物質)に磁石を近づけて、ようすを観察する
- 試験管A(加熱していない混合物)と試験管B(加熱後の物質)に塩酸を加え、反応のようすを観察する
硫化鉄ができる実験の注意点
硫化鉄ができる実験では、次のような点に注意しましょう。
硫化鉄ができる実験の注意点と理由
- 気体のにおいは、手であおいでかぐ
[理由]気体を深く吸い込まないようにするため - 反応が始まり赤く色が変わり始めたら、加熱をやめる
[理由]反応によって熱や光が発生するため - 加熱中は試験管に脱脂綿でゆるく栓をする
[理由]硫黄の蒸気が出るのを防ぐため
なお、上記の注意点2の理由は「反応によって発生した熱で、反応が続くから」または「反応で 発生した熱で、次々に反応が進んだから」でもOKです。
硫化鉄ができる実験の結果
硫化鉄ができる実験では、反応前後の物質を比べるために、次のように2本の試験管を用意します。
硫化鉄ができる実験で比べる物質
- 試験管A;加熱していない混合物
- 試験管B;加熱後の物質
硫化鉄ができる実験では、反応前後の物質を比べるために、次の3つの手順で物質の性質を調べます。
反応前後の物質の性質を調べる手順
- 試験管Aと試験管Bの色などを観察する
- 試験管Aと試験管Bに磁石を近づけて、ようすを観察する
- 試験管Aと試験管Bに塩酸を加え、反応のようすを観察する
上記の試験管Aと試験管Bの性質を調べた結果は、次のとおりです。
結果1.試験管A;加熱していない鉄と硫黄の混合物
試験管Aの物質の性質は、次のとおりです。
【結果】加熱していない鉄と硫黄の混合物の性質
- 灰色
- 磁石につく
- 塩酸を加えると、無臭の気体が発生する
結果2.試験管B;加熱後の物質
試験管Bの物質の性質は、次のとおりです。
【結果】加熱後の物質の性質
- 黒色
- 磁石につきにくい
- 塩酸を加えると、特有のにおいがある気体が発生する※卵がくさったようなにおい
硫化鉄ができる実験の考察
試験管Aと試験管Bの物質を調べた実験結果をもとに、本実験について考察します。
まず、試験管Aと試験管Bの物質の性質を、下のようにまとめます。
【試験管A】加熱していない鉄と硫黄の混合物の性質
- 灰色
- 磁石につく
- 塩酸を加えると、無臭の気体が発生する
【試験管B】加熱後の物質の性質
- 黒色
- 磁石につきにくい
- 塩酸を加えると、特有のにおいがある気体が発生する※卵がくさったようなにおい
試験管A(反応前)と試験管B(反応後)の物質の性質から、次のことが考察できます。
【考察】
- 加熱の前後で性質がちがうため、鉄と硫黄が結びついて別の物質(化合物)ができた
- 加熱後に鉄と硫黄が結びついてできた物質は、硫化鉄である
- 加熱後の物質(硫化鉄)に塩酸を加えると、硫化水素が発生する
- 鉄と硫黄の混合物に塩酸を加えると発生する無臭の気体は、水素である
[理由]鉄に塩酸を加えると、水素が発生するから
硫化鉄ができる反応の化学反応式
硫化鉄ができる反応の化学反応式は、次のとおりです。
硫化鉄ができる反応の化学反応式
Fe + S → FeS
鉄 + 硫黄 → 硫化鉄
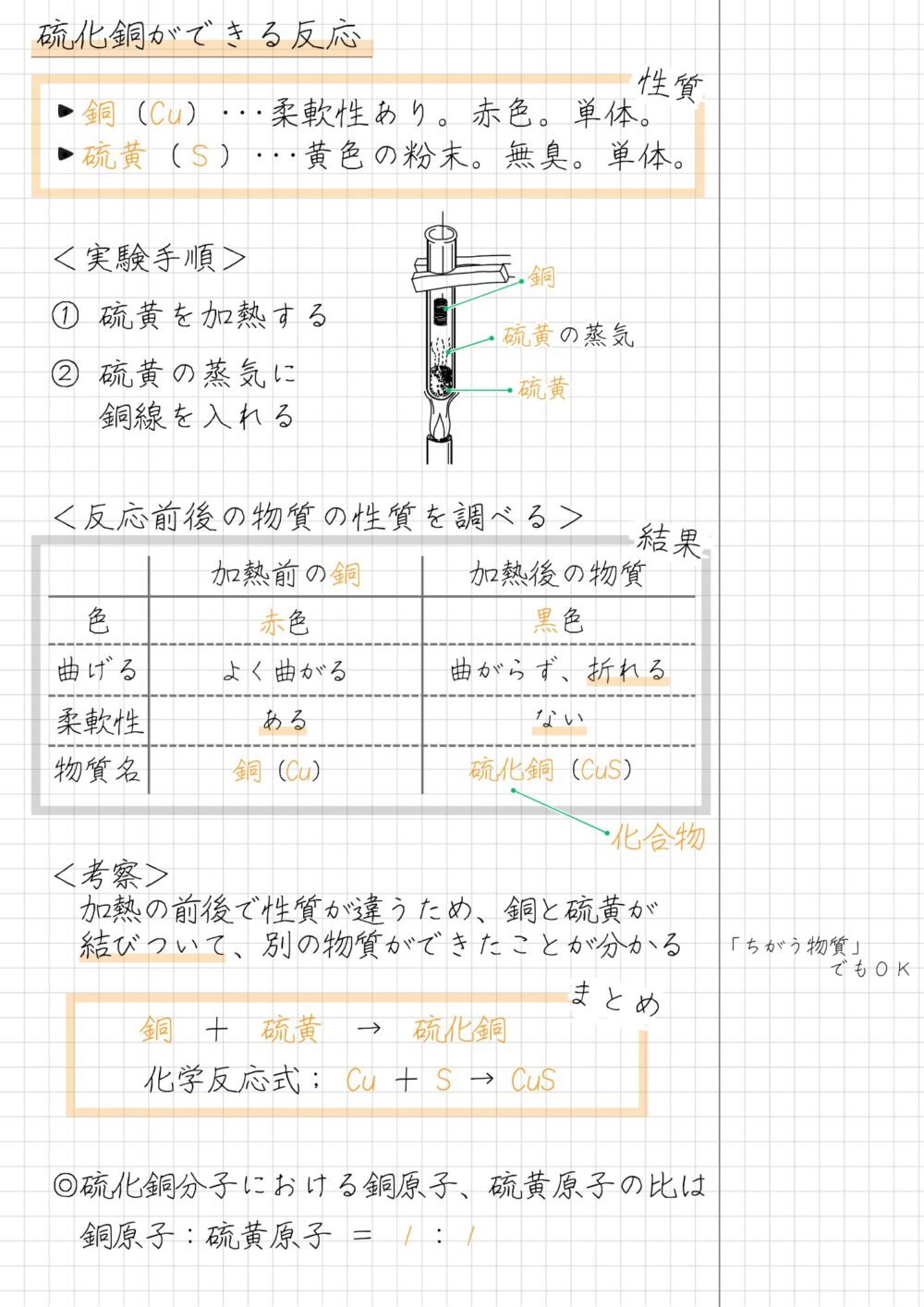
銅と硫黄から硫化銅ができる反応|Cu+S→CuS
非金属の硫黄と金属の銅が結びつくと、硫化銅になります。
本章では、硫化銅ができる反応を解説します。
本章で学べる内容
- 硫化銅の性質
- 硫化銅ができる実験の手順
- 硫化銅ができる実験の注意点
- 硫化銅ができる実験の結果
- 硫化銅ができる実験の考察
- 硫化銅ができる実験の化学反応式
硫化銅の性質
硫化銅は分子をつくらない物質で、化学式がCuSです。
硫化銅は銅と硫黄による化合物で、黒色粉末または青黒色の結晶です。
硫化銅ができる実験の手順
硫化銅ができる実験の手順は、次のとおりです。
硫化銅ができる実験の手順
- 硫黄を入れた試験管を加熱する
- 銅線を、試験管内の硫黄の蒸気にふれさせる
- 赤く色が変わり始めたら加熱をやめ、変化のようすを観察する
- 加熱後の物質の色や柔軟性を確かめる
硫化銅ができる実験の結果
硫化銅ができる実験では、反応前後の物質を比べるために、次のように2本の銅線を用意します。
硫化銅ができる実験で比べる物質
- 硫黄の蒸気で反応させていない銅線A
- 硫黄の蒸気で反応させる銅線B
硫化銅ができる実験では、反応前後の物質を比べるために、次の2つの手順で物質の性質を調べます。
反応前後の物質の性質を調べる手順
- 赤く色が変わり始めたら加熱をやめ、変化のようすを観察する
- 加熱後の物質の色や柔軟性を確かめる
上記の銅線Aと銅線Bの性質を調べた結果は、次のとおりです。
結果1.銅線A;硫黄の蒸気で反応させていない
銅線Aの性質は、次のとおりです。
【結果】硫黄の蒸気で反応させていない銅線の性質
- 赤色
- よく曲がる
- 柔軟性がある
結果2.銅線B;硫黄の蒸気で反応させる
加熱後の銅線Bの性質は、次のとおりです。
【結果】加熱後の物質の性質
- 銅と硫黄が激しく反応し、反応中は赤くなる
- 黒色
- 曲がらずに折れる、もろい
- 柔軟性がない
硫化銅ができる実験の考察
銅線Aと銅線Bの性質を調べた実験結果をもとに、本実験について考察します。
まず、銅線Aと銅線Bの物質の性質を、下のようにまとめます。
【銅線A】硫黄の蒸気で反応させていない銅線の性質
- 赤色
- よく曲がる
- 柔軟性がある
【銅線B】加熱後の物質の性質
- 銅と硫黄が激しく反応し、反応中は赤くなる
- 黒色
- 曲がらずに折れる、もろい
- 柔軟性がない
銅線A(反応前)と銅線B(反応後)の性質から、次のことが考察できます。
【考察】
- 加熱の前後で性質がちがうため、銅と硫黄が結びついて、別の物質(化合物)ができた
- 加熱後に銅と硫黄が結びついてできる化合物は、硫化銅である
硫化銅ができる反応の化学反応式
硫化銅ができる反応の化学反応式は、次のとおりです。
硫化銅ができる反応の化学反応式
Cu + S → CuS
銅 + 硫黄 → 硫化銅
【まとめノート】実験の注意点を整理して理解しよう|中2理科 化学
本記事では、中学2年で学習する「結びついて化合物ができる化学反応」を解説しました。水、塩化銅、硫化鉄、硫化銅を、実験を中心にまとめました。
化学変化や化学反応式について復習したい方は、下のノートを参考にしてください▼
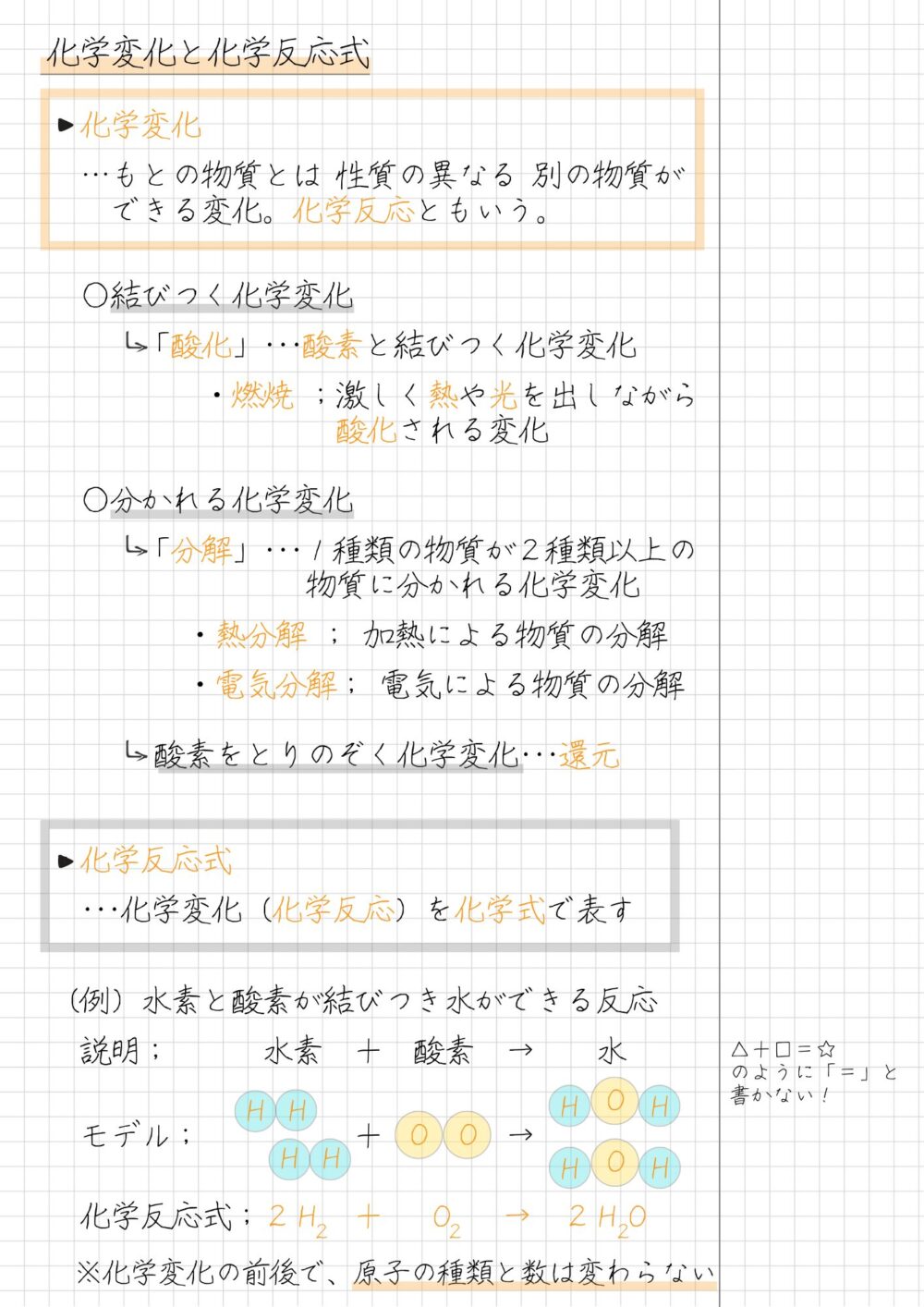
本記事では、結びつく化学変化のうち、酸化以外の化学反応を詳しくまとめました。
- 酸素と結びつく化学変化
- 塩素と結びつく化学変化
- 硫黄と結びつく化学変化
結びついて化合物ができる化学反応式は、次のようにノートにまとめました。参考にしてください▼
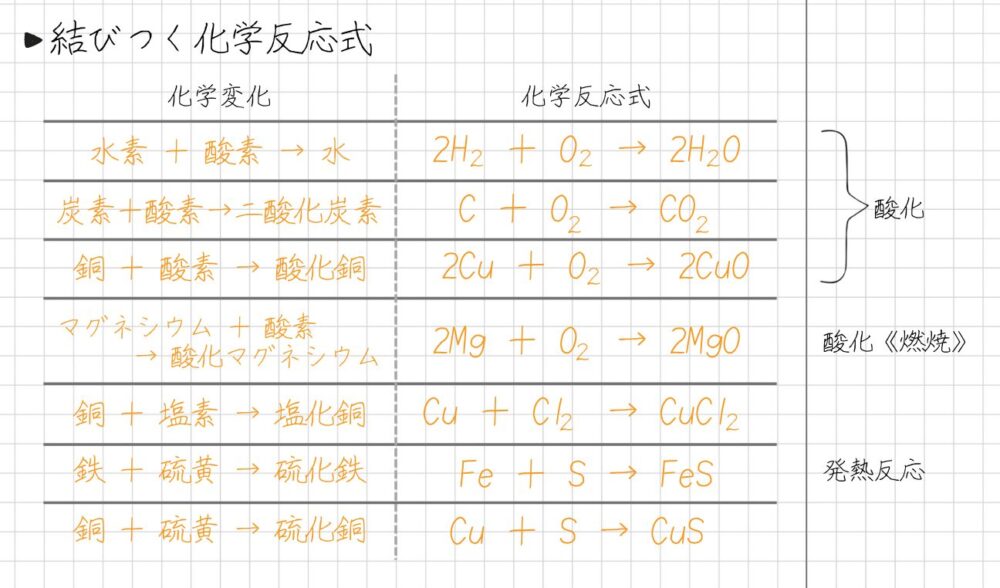
- 酸化_水ができる反応
2H₂+O₂→2H₂O - 酸化_二酸化炭素ができる反応
C+O₂→CO₂ - 酸化_酸化銅ができる反応
2Cu+O₂→2CuO - 酸化_マグネシウムの燃焼
2Mg+O₂→2MgO - 塩化銅ができる反応
Cu+Cl₂→CuCl₂ - 硫化鉄ができる反応
Fe+S→FeS - 硫化銅ができる反応
Cu+S→CuS
水ができる反応を実験を中心にまとめノート形式でまとめました▼
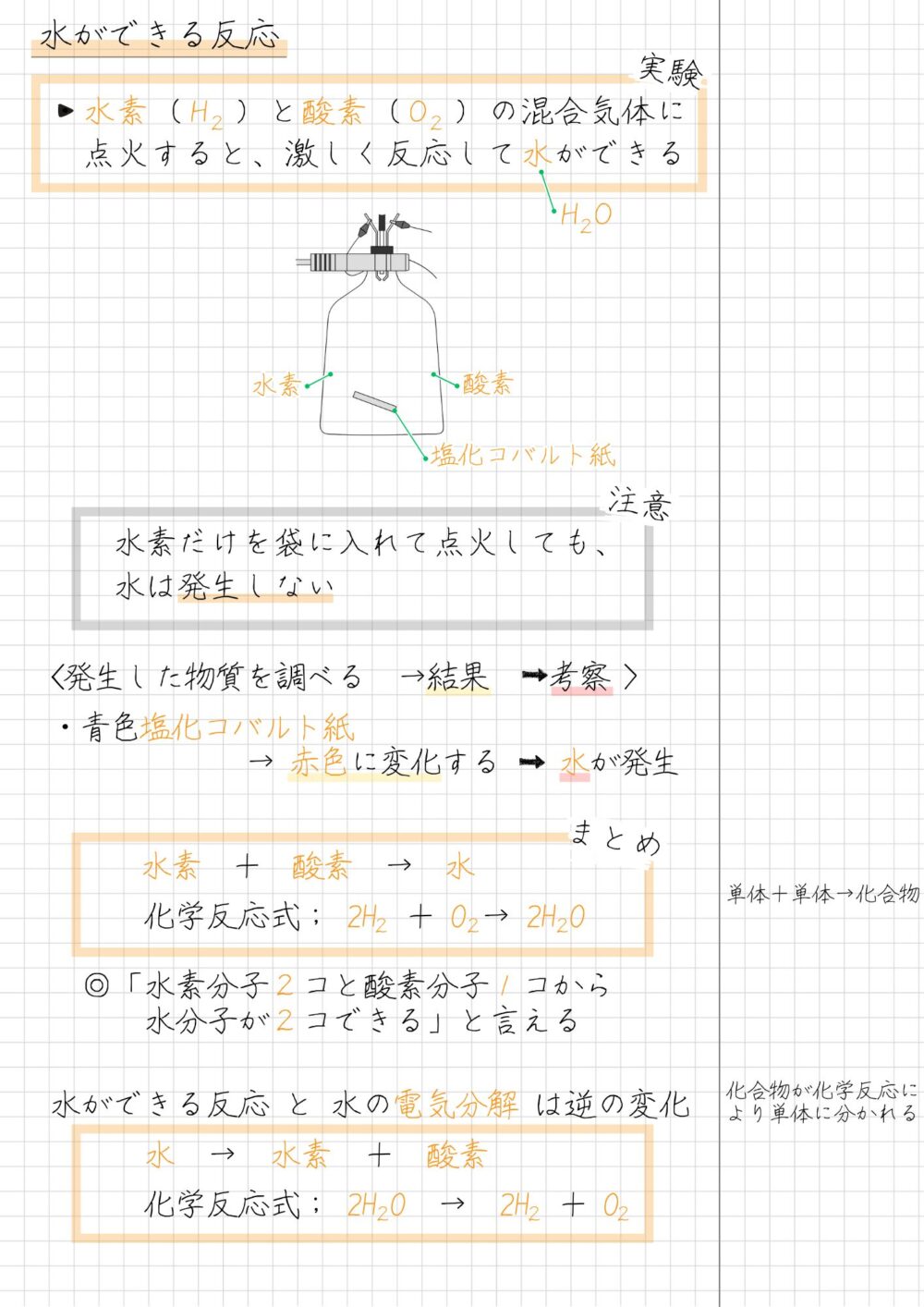
水ができる化学反応の重要ポイントは、次のとおりです。
水ができる反応
- 化学反応式
2H₂ + O₂ → 2H₂O
水素 + 酸素 → 水 - 水を確かめる方法
青色の塩化コバルト紙が赤色に変化する - 水の電気分解と真逆の反応が起きる
2H₂O → 2H₂ + O₂
水 → 水素 + 酸素
塩化銅ができる反応のまとめノートは、次のようにするといいでしょう▼
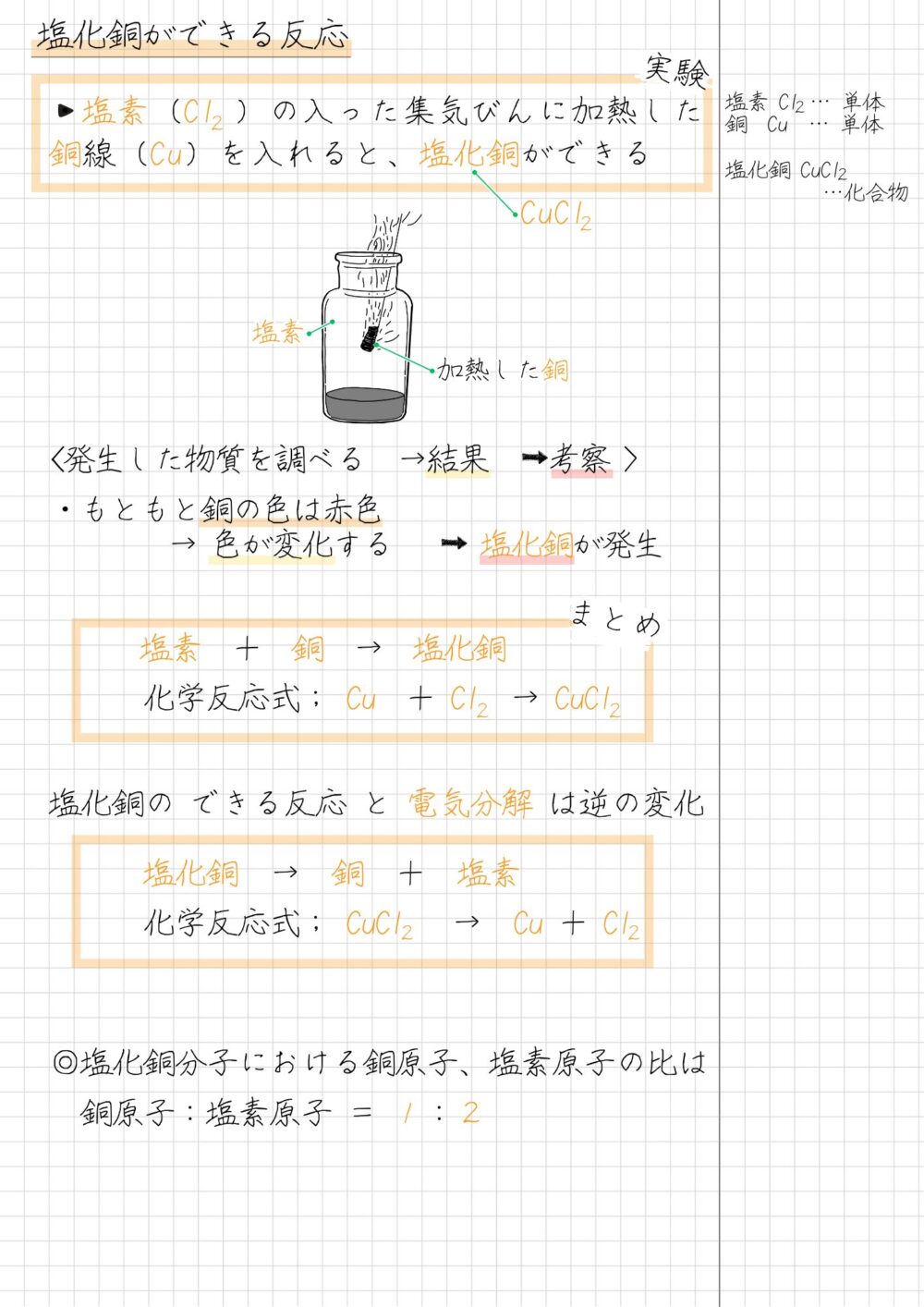
塩化銅ができる化学反応の重要ポイントは、次のとおりです。
塩化銅ができる反応
- 化学反応式
Cu + Cl₂ → CuCl₂
銅 + 塩素 → 塩化銅 - 塩化銅の電気分解と真逆の反応が起きる
CuCl₂ → Cu + Cl₂
塩化銅 → 銅 + 塩素
硫化鉄ができる反応のまとめノートは、次のようにするといいでしょう▼

硫化鉄ができる化学反応の重要ポイントは、次のとおりです。
硫化鉄ができる反応
- 化学反応式
Fe + S → FeS
鉄 + 硫黄 → 硫化鉄 - 反応によって熱や光が発生するため、加熱をやめても反応が続く
- 塩酸を加えると発生する気体
加熱していない混合物に塩酸→水素H₂
加熱後の硫化鉄に塩酸→硫化水素H₂S
硫化銅ができる反応のまとめノートは、次のようにするといいでしょう▼
以上、中学2年生の化学分野『結びついて化合物ができる化学反応』の解説でした。
熱分解は、こちらから復習できます▼


電気分解は、こちらから復習できます▼


入試や定期テストでよく出る化学反応式一覧は、こちらからどうぞ▼


この記事が、皆さんの理解のお役に立てれば幸いです。






