置換法・薬品・注意点・実験結果に分けてまとめるといいですよ!
そこでこの記事では、理科ノートが整理できなくなってきた方でも理解できるよう、中1理科の化学分野『気体発生』をまとめて解説します。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。ノートにまとめて学習したい方は、ぜひ最後までお読みください。
空気に含まれる気体|中1理科 化学
空気には、次の気体が含まれています。
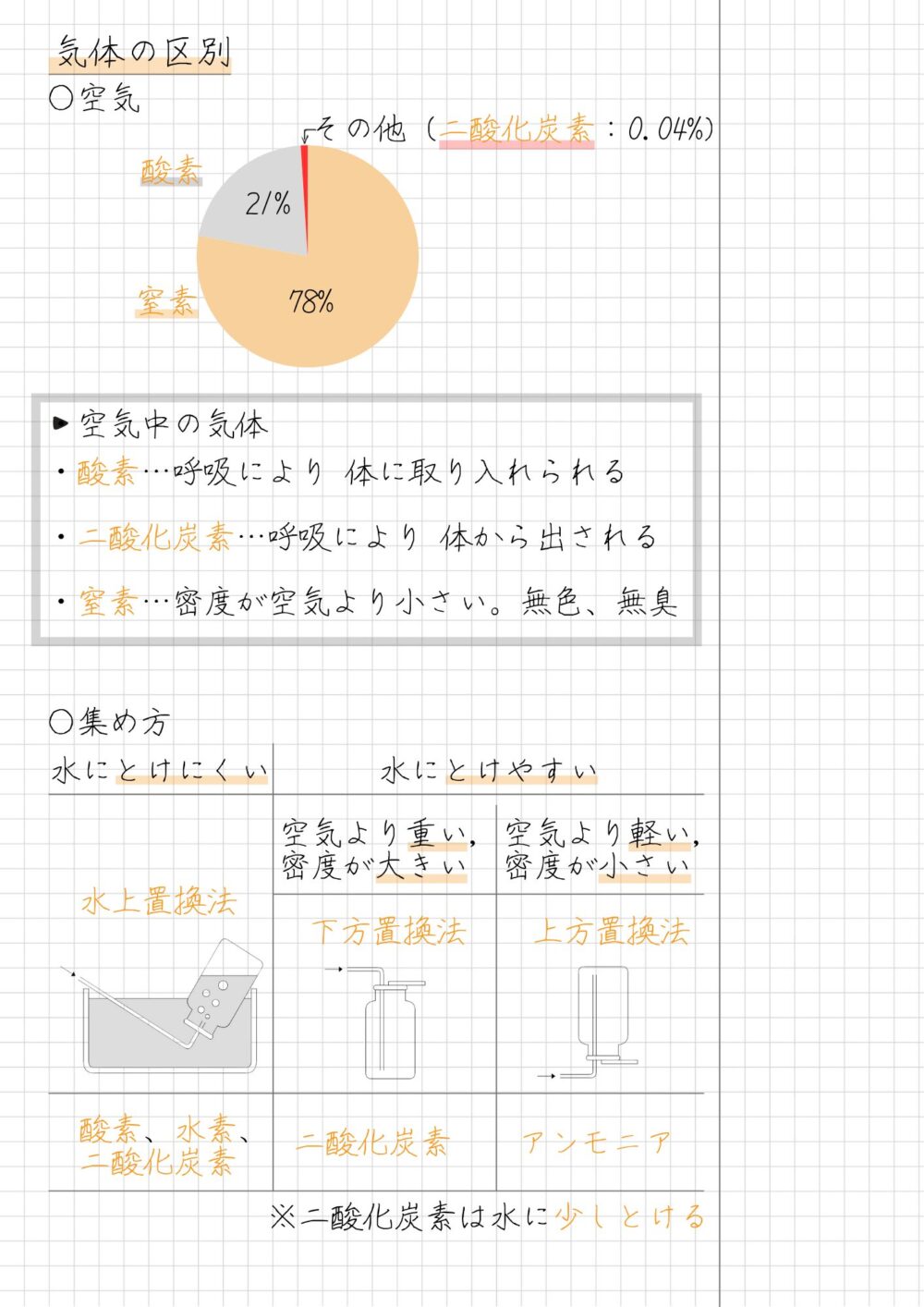
空気中の気体の種類と割合
- 窒素:78%
- 酸素:21%
- 二酸化炭素:0.04%
酸素は、呼吸により生物の体に取り入れられます。
二酸化炭素は、逆に呼吸により生物の体から出される気体です。
窒素は密度が空気より小さくて、無色無臭の気体です。
気体の集め方|水上置換・上方置換・下方置換
実験で発生した気体を集める方法は、次の3つです。
気体の集め方
- 水上置換法
- 上方置換法
- 下方置換法
本章では、上記の集め方を、項目に分けて詳しく解説します。
水上置換法|酸素・窒素・二酸化炭素
水上置換法は、水にとけにくい気体を集める方法です。
主に、次の3つの気体を集めるときに使います。
水上置換法で集める気体
- 酸素
- 水素
- 二酸化炭素
※二酸化炭素は水に少しとけるため、下方置換法で集める方がよい
上方置換法|アンモニア
上方置換法は水にとけやすい気体を集める方法です。
アンモニアなどの空気より密度が小さい(軽い)気体を集めるときに、上方置換法を用います。
下方置換法|二酸化炭素
下方置換法は水にとけやすい気体を集める方法です。
二酸化炭素などの空気より密度が大きい(重い)気体を集めるときに、下方置換法を用います。
気体の性質の確かめ方|中1理科 化学
本章では、発生した気体の性質を確かめる方法を解説します。
気体の性質の確かめ方
- 石灰水…二酸化炭素かを確かめる
- 線香…酸素かを確かめる
- マッチ…水素かを確かめる
- リトマス紙…酸性かアルカリ性かを確かめる
- フェノールフタレイン溶液…アルカリ性を確かめる
- BTB溶液…酸性・中性・アルカリ性を確かめる
石灰水|二酸化炭素かを確かめる
石灰水で気体の性質を確かめる手順は、次のとおりです。
石灰水で気体の性質を確かめる手順
- 石灰水を容器に入れる
※集気びんや試験管など - 気体を容器に入れる
- ふたをしてよく振る
石灰水と気体が反応すると分かることは、次のとおりです。
石灰水の結果と考察
- 石灰水が白くにごると、気体は二酸化炭素であると分かる
石灰水は理科的には、水酸化カルシウム(消石灰)と言います。
アルカリ性の水溶液です。
二酸化炭素を通すと白くにごるのは、反応により炭酸カルシウムを発生しているためです。
線香|酸素かを確かめる
線香で気体の性質を確かめる手順は、次のとおりです。
線香で気体の性質を確かめる手順
- 気体を容器に集め、ふたをしておく
※集気びんや試験管など - 線香に火をつけ、容器に線香を入れる
容器に線香を入れると分かることは、次のとおりです。
線香の結果と考察
- 線香が激しく燃えると、気体は酸素であると分かる
- 二酸化炭素の場合、火が消える
マッチ|水素かを確かめる
マッチで気体の性質を確かめる手順は、次のとおりです。
マッチで気体の性質を確かめる手順
- 気体を試験管に集め、ゴム栓をしておく
- マッチに火をつけ、試験管の口にななめ下から近づける
容器にマッチの火を近づけると分かることは、次のとおりです。
マッチの結果と考察
- マッチの火を近づけ、音を立てて燃えると、気体は水素だと分かる。
リトマス紙|酸性かアルカリ性かを確かめる
リトマス紙では、次のことが分かります。
リトマス紙で分かること
【赤色リトマス紙】
- 赤色が青色に変化…アルカリ性
- 赤色のまま変化なし…中性か酸性
【青色リトマス紙】
- 青色が赤色に変化…酸性
- 青色のまま変化なし…中性かアルカリ性
フェノールフタレイン溶液|アルカリ性を確かめる
フェノールフタレイン溶液は、アルカリ性を確かめる試薬です。
フェノールフタレイン溶液の性質は、次のとおりです。
フェノールフタレイン溶液の性質
- もともと無色透明の液体
- アルカリ性と反応すると赤色に変化する
- 酸性や中性では変化なしで無色のまま
酸素の発生方法と性質|中1理科 化学
本章では、酸素に関する次の内容を解説します。
本章で学べる内容
- 酸素の性質
- 酸素を発生させる薬品
- 酸素の発生実験の手順と注意点
- 酸素の発生実験の結果と考察
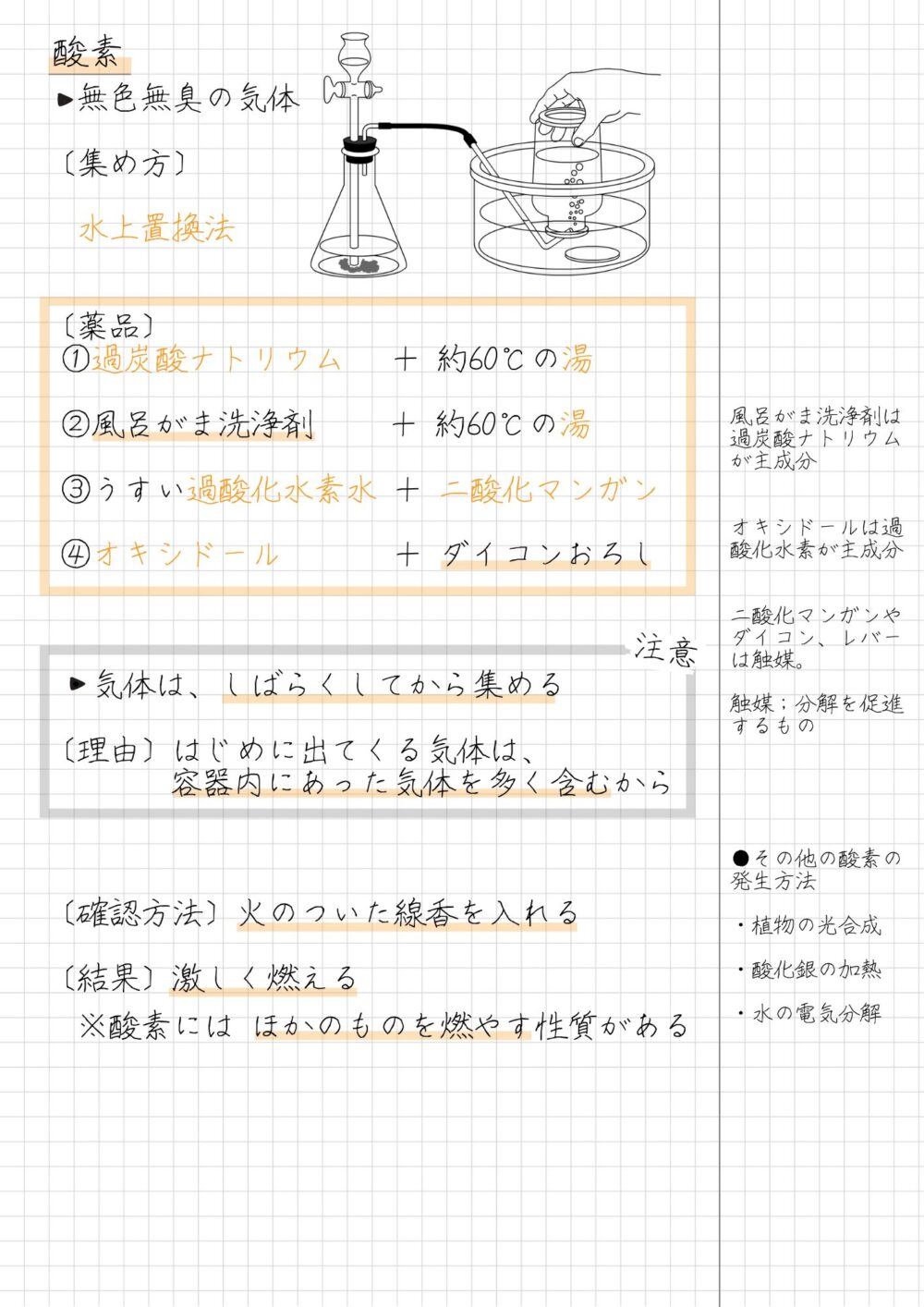
酸素の性質
酸素の性質は次のとおりです。
酸素の性質
- 無色・無臭の気体
- 空気中におよそ21%含まれている
- 酸素は空気と比べ、密度が少し大きい(重い)
- 水にとけにくい
- ものを燃やすはたらきがある
水にとけにくいため、酸素は水上置換法で集められる。
酸素を発生させる薬品
酸素を発生させる薬品の組み合わせは、次のとおりです。
酸素を発生させる薬品
- 過炭酸ナトリウム+約60℃の湯
- 風呂がま洗浄剤+約60℃の湯
- うすい過酸化水素水+二酸化マンガン
- オキシドール+ダイコンおろし
- オキシドール+レバー
ふろがま洗浄剤の主な成分は、過炭酸ナトリウムです。
つまり、上記の1と2の方法は、過炭酸ナトリウムに湯を加える方法だと言えます。
オキシドールの主な成分は、過酸化水素水です。
二酸化マンガンやダイコンおろし、レバーは触媒と言われ、分解を速めます。
つまり、上記の3・4・5の方法はすべて、過酸化水素水を分解する実験だと言えます。
酸素の発生実験の手順と注意点
酸素発生実験の手順は次のとおりです。
酸素発生実験の手順
- 薬品を三角フラスコにとり、気体を発生させる
- 発生した気体を、水上置換法で2本の試験管に集め、ゴム栓をする
- 気体を集めた2本の試験管のうち1本に、火のついた線香を入れ、反応のようすを観察する
- もう1本の試験管に石灰水を入れ、再びゴム栓をしてよく振り、反応のようすを観察する
- 別の薬品の組み合わせで、同様の実験を行う
酸素発生実験の注意点は次のとおりです。
酸素発生実験の注意点
- 気体はしばらくしてから集める(1本目の気体は捨てる)
[理由]はじめに出てくる気体は、容器内にあった気体を多く含むため
酸素の発生実験の結果と考察
酸素発生実験の結果は次のとおりです。
酸素発生実験の結果
- 火のついた線香を入れると、激しく燃える
- 石灰水に通すと、変化がない
上記の酸素発生実験の結果から考察できることは、次のとおりです。
酸素発生実験の考察
- 酸素にはものを燃やすはたらきがあることが分かる
- どのような薬品から出てきた酸素でも、同じ性質を示すことが分かる
二酸化炭素の発生方法と性質|中1理科 化学
本章では、二酸化炭素に関する次の内容を解説します。
本章で学べる内容
- 二酸化炭素の性質
- 二酸化炭素を発生させる薬品
- 二酸化炭素の発生実験の手順と注意点
- 二酸化炭素の発生実験の結果と考察
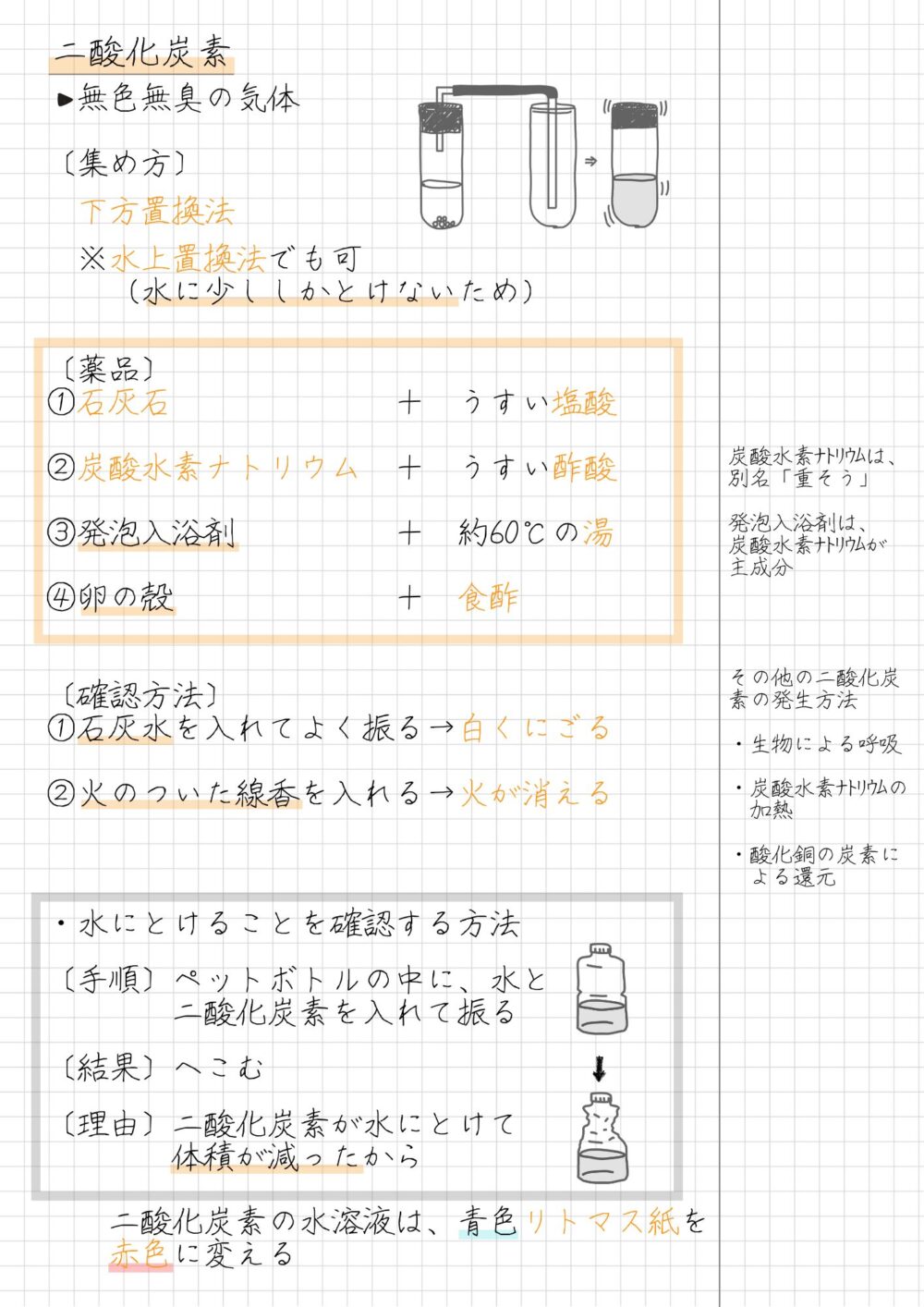
二酸化炭素の性質
二酸化炭素の性質は次のとおりです。
二酸化炭素の性質
- 無色・無臭の気体
- 空気中におよそ0.04%含まれている
- 二酸化炭素は空気と比べ、密度が大きい(重い)
- 水に少しとける
- ものを燃やすはたらきがない
- 石灰水を白くにごらせる
- 水溶液は炭酸水といい、酸性
- 二酸化炭素の固体はドライアイス
二酸化炭素は下方置換法で集められます。
なお、二酸化炭素は水に少ししかとけないため、水上置換法でも集められます。
二酸化炭素を発生させる薬品
二酸化炭素を発生させる薬品の組み合わせは、次のとおりです。
二酸化炭素を発生させる薬品
- 石灰石+うすい塩酸
- 炭酸水素ナトリウム+うすい酢酸
- 発泡入浴剤+約60℃の湯
- 卵の殻+食酢
炭酸水素ナトリウムは「重曹(じゅうそう)」と言われ、料理や掃除などによく用いられます。
ちなみに、発泡入浴剤の主な成分は、炭酸水素ナトリウムです。
二酸化炭素の発生実験の手順と注意点
二酸化炭素発生実験の手順は次のとおりです。
二酸化炭素発生実験の手順
- 薬品を試験管にとり、気体を発生させる
- 発生した気体を、下方置換法で2本の試験管に集め、ゴム栓をする
- 気体を集めた2本の試験管のうち1本に、火のついた線香を入れ、反応のようすを観察する
- もう1本の試験管に石灰水を入れ、再びゴム栓をしてよく振り、反応のようすを観察する
- 別の薬品の組み合わせで、同様の実験を行う
二酸化炭素発生実験の注意点は次のとおりです。
二酸化炭素発生実験の注意点
- 気体はしばらくしてから集める(1本目の気体は捨てる)
[理由]はじめに出てくる気体は、容器内にあった気体を多く含むため
二酸化炭素の発生実験の結果と考察
二酸化炭素発生実験の結果は次のとおりです。
二酸化炭素発生実験の結果
- 火のついた線香を入れると、火が消える
- 石灰水に通すと、白くにごる
上記の二酸化炭素発生実験の結果から考察できることは、次のとおりです。
二酸化炭素発生実験の考察
- 石灰水を白くにごらせる性質がある
- 二酸化炭素にはものを燃やすはたらきがないことが分かる
- どのような薬品から出てきた二酸化炭素でも、同じ性質を示すことが分かる
水素の発生方法と性質|中1理科 化学
本章では、水素に関する次の内容を解説します。
本章で学べる内容
- 水素の性質
- 水素を発生させる薬品
- 水素の発生実験の手順と注意点
- 水素の発生実験の結果と考察
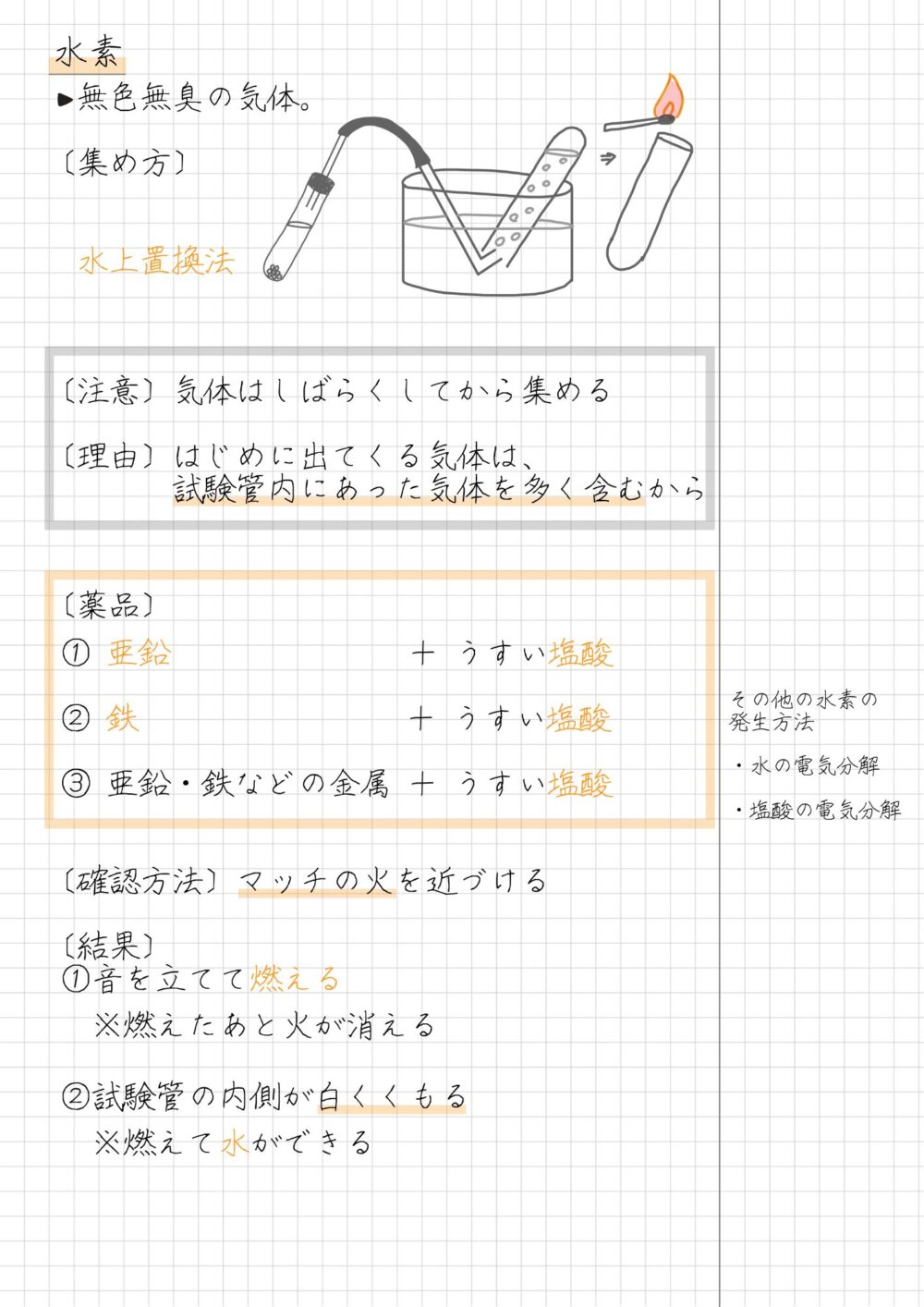
水素の性質
水素の性質は次のとおりです。
水素の性質
- 無色・無臭の気体
- 水素は空気と比べ、密度が非常に小さい(軽い)
- 水にとけにくいため、水上置換法で集める
- 空気中で火をつけると、音を立てて燃え、水ができる
水素を発生させる薬品
水素を発生させる薬品の組み合わせは、次のとおりです。
水素を発生させる薬品
- 亜鉛+うすい塩酸
- 鉄+うすい塩酸
※亜鉛や鉄以外でも、塩酸にとける金属は、とけるときに水素を発生する
水素の発生実験の手順と注意点
水素発生実験の手順は次のとおりです。
水素発生実験の手順
- 薬品を試験管にとり、気体を発生させる
- 発生した気体を、水上置換法で試験管に集め、ゴム栓をする
- 試験管の口に、火をつけたマッチを近づけ、反応のようすを観察する
- 別の薬品の組み合わせで、同様の実験を行う
水素発生実験の注意点は次のとおりです。
水素発生実験の注意点
- 気体はしばらくしてから集める(1本目の気体は捨てる)
[理由]はじめに出てくる気体は、容器内にあった気体を多く含むため
水素の発生実験の結果と考察
水素発生実験の結果は次のとおりです。
水素発生実験の結果
- マッチの火を近づけると、音を立てて燃える
- マッチを近づけた試験管の口付近がくもり、水滴がつく
上記の水素発生実験の結果から考察できることは、次のとおりです。
水素発生実験の考察
- 空気中で燃えると水を発生する性質がある
- どのような薬品から出てきた水素でも、同じ性質を示す
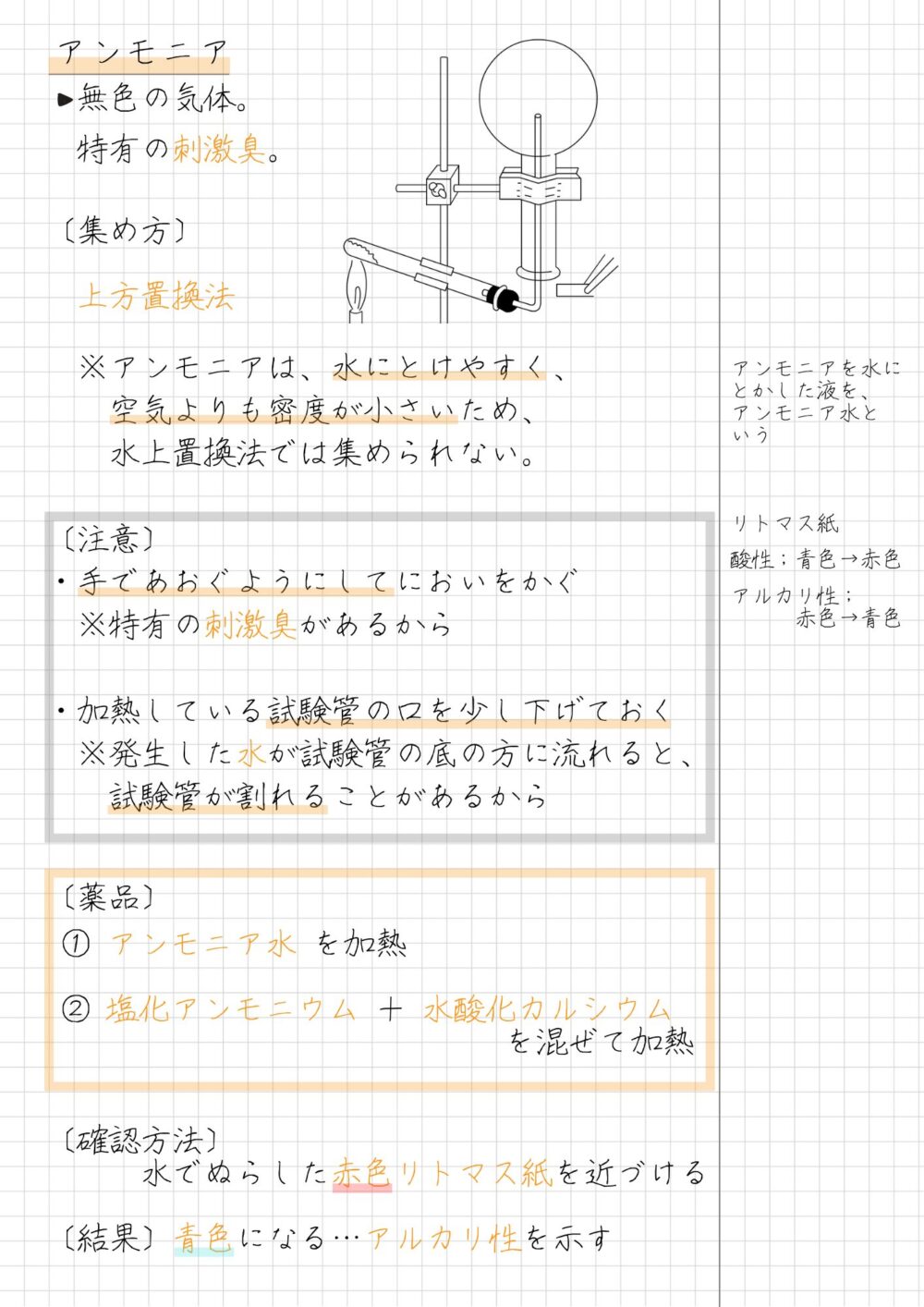
アンモニアの発生方法と性質|中1理科 化学
本章では、アンモニアに関する次の内容を解説します。
本章で学べる内容
- アンモニアの性質
- アンモニアを発生させる薬品
- アンモニアの発生実験の手順と注意点
- アンモニアの発生実験の結果と考察
アンモニアの性質
アンモニアの性質は次のとおりです。
アンモニアの性質
- 無色の気体
- 刺激臭があり、有毒
- アンモニアは空気と比べ、密度が小さい(軽い)
- 水に非常にとけやすいため、上方置換法で集める
- 水溶液はアルカリ性を示す
アンモニアを発生させる薬品
アンモニアを発生させる薬品の組み合わせは、次のとおりです。
アンモニアを発生させる方法
- 塩化アンモニウム+水酸化カルシウム の混合物を加熱
- アンモニア水を加熱
アンモニアの発生実験の手順と注意点
アンモニア発生実験の手順は次のとおりです。
アンモニア発生実験の手順
- 塩化アンモニウムと水酸化カルシウムの混合物を試験管にとり、加熱する
- 発生した気体を、上方置換法で丸底フラスコに集め、ゴム栓をする
- 丸底フラスコの口に、水でぬらした赤色リトマス紙を近づけ、色の変化を観察する
アンモニア発生実験の注意点は次のとおりです。
アンモニア発生実験の注意点
- 手であおぐようにしてにおいをかぐ
[理由]特有の刺激臭があるから - 加熱している試験管の口を少し下げておく
[理由]発生した液体が試験管の底の方に流れると、試験管が割れることがあるから
アンモニアの発生実験の結果と考察
アンモニア発生実験の結果は次のとおりです。
アンモニア発生実験の結果
- 赤色リトマス紙の色が青色に変化する
- 特有の刺激臭が発生する
上記のアンモニア発生実験の結果から考察できることは、次のとおりです。
アンモニア発生実験の考察
- アンモニアの水溶液はアルカリ性を示す
その他の気体|中1理科 化学
本章では、中学理科でよく出る気体の性質を解説します。
本章で学べる気体
- 窒素(ちっそ)
- 塩素(えんそ)
- 塩化水素(えんかすいそ)
- 硫化水素(りゅうかすいそ)
- 一酸化炭素(いっさんかたんそ)
- 二酸化窒素(にさんかちっそ)
- 二酸化硫黄(にさんかいおう)
- メタン
窒素(ちっそ)
窒素の性質は、次のとおりです。
窒素の性質
- 無色、無臭の気体
- 水にとけにくいため、水上置換法で集める
- 空気中に約78%含まれている
- ほかの物質と結びつかず、変化しにくい
窒素は袋や缶、びんなどの食品に封入されることが多いです。理由は、他の物質と結びつきにくい性質があるからです。
塩素(えんそ)
塩素の性質は、次のとおりです。
塩素の性質
- 黄緑色(おうりょくしょく)、刺激臭をもつ気体。有毒
- 水にとけやすく空気より重いため、下方置換法で集める
- 水溶液は酸性
- 殺菌作用や漂白作用がある
漂白剤には「混ぜるな危険」という表示がよく見られます。これは、有毒な気体(塩素など)が発生するからです。
リトマス紙の色が消える。
リトマス紙といえば、ふつう赤色や青色と答えたくなりますが、漂白作用のため色がなくなります。
塩化水素(えんかすいそ)
塩化水素の性質は、次のとおりです。
塩化水素の性質
- 無色、刺激臭の気体。有毒
- 水に非常にとけやすく空気より重いため、下方置換法で集める
- 水溶液は酸性
塩化水素を水にとかしたものが塩酸です。
硫化水素(りゅうかすいそ)
硫化水素の性質は、次のとおりです。
硫化水素の性質
- 無色、有毒な気体
- 水にとけやすく空気より重いため、下方置換法で集める
- 特有のにおいをもつ。卵が腐ったようなにおい(腐卵臭ーふらんしゅう)がする。
硫化水素は火山ガスに含まれ、天然温泉などの特有のにおいのもとになっています。
一酸化炭素(いっさんかたんそ)
一酸化炭素の性質は、次のとおりです。
一酸化炭素の性質
- 無色、無臭の気体
- 水に少しとけ空気より軽いため、上方置換法で集める
一酸化炭素は「一酸化炭素中毒」というフレーズで有名です。酸素と結びつきやすく、血液中の酸素を奪うため、吸入すると非常に危険です。
二酸化窒素(にさんかちっそ)
二酸化窒素の性質は、次のとおりです。
二酸化窒素の性質
- 赤褐色、特有の刺激臭がある気体
- 水に非常にとけやすく空気より重いため、下方置換法で集める
二酸化窒素は、化学肥料や爆薬の製造に関わっています。
大気汚染の原因物質の一つです。
二酸化硫黄(にさんかいおう)
二酸化硫黄の性質は、次のとおりです。
二酸化硫黄の性質
- 無色、特有の刺激臭がある気体
- 水にとけやすく空気より重いため、下方置換法で集める
二酸化硫黄は、保存料や防腐剤、消毒剤として使用されます。
酸性雨の原因物質の一つです。
メタン
メタンの性質は、次のとおりです。
メタンの性質
- 無色、無臭の気体
- 水にとけにくいため、水上置換法で集める
メタンは天然ガス(都市ガス)の主成分です。
メタンは燃えやすく、燃えると二酸化炭素と水が発生します。中学2年の「有機物の燃焼」で詳しく解説します(下の記事)。
【まとめ】実験をまとめる者は気体を制す!|中1理科 化学
中学1年の化学分野「気体の発生」を解説しました。
空気中の気体と、気体の集め方は、下のノートのようにまとめるといいでしょう。
![]()
酸素の発生実験は、下のように薬品や注意点と結果を1ページにおさめると理解しやすいです。
![]()
二酸化炭素は、下のノートのように整理してまとめましょう。
![]()
水素の発生実験は、下のようにまとめましょう。
![]()
アンモニアは他の気体よりもイメージしにくいため、きちんと自分の手で書いて理解することをおすすめします。下図を参考にしてください。
![]()
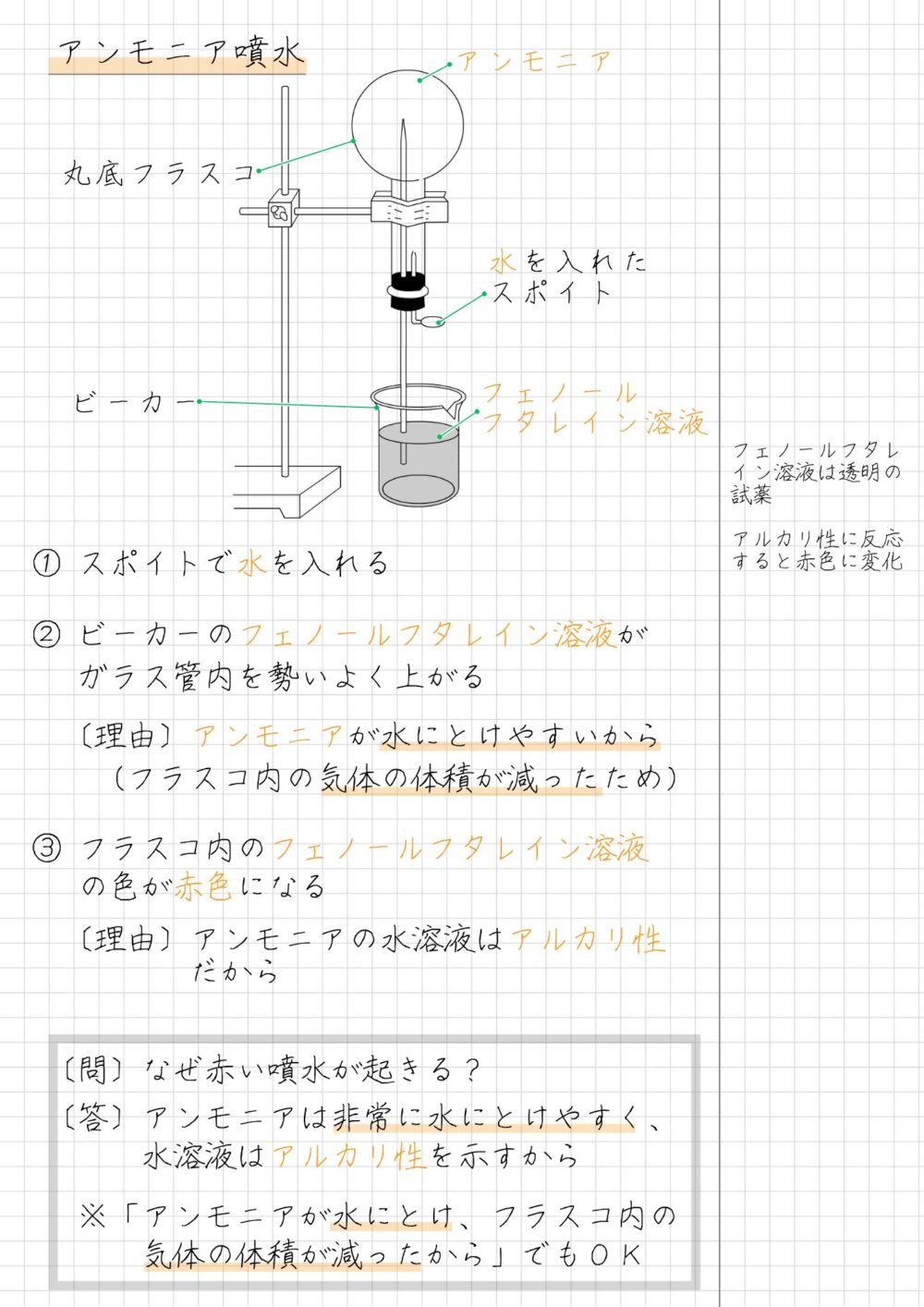
テストでも出題されやすいアンモニア噴水については、下のように整理してまとめると理解しやすいです。
![]()
その他の気体で、特に覚えてほしい内容をまとめました。参考にしてください。
![]()

テスト前の復習用として「気体まとめノート」をつくりました。
下のノートでは、特に重要なポイントだけをおさえています。


以上「気体の発生」の解説でした。






