そこでこの記事では、理科の勉強がキライな方でも理解できるよう、中2理科の化学分野『質量保存の法則』のキホンを解説します。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。理科を何とかしたい方は、ぜひ最後までお読みください。
質量保存の法則とは?|中2理科 化学
質量保存の法則は、250年も前の1774年にフランスのラボアジエという科学者が発見した法則です。
本章で学べる内容は、次のとおりです。
本章で学べる内容
- 質量保存の法則のポイント
- 質量保存の法則を確かめる実験
質量保存の法則のポイント2つ
質量保存の法則について、押さえるべきポイントは次の2点です。
質量保存の法則
- 化学変化の前後で、反応に関係する物質全体の質量は変わらない
- 化学変化によって、物質をつくる原子の組み合わせは変化するが、原子の種類と数は変わらない
質量保存の法則を確かめる実験3つ
質量保存の法則を確かめるために、中学理科では次の3つの実験がよく出題されます。
【質量保存の法則】よく出る実験3選
- 硫酸バリウム沈殿ができる反応
硫酸+水酸化バリウム→
硫酸バリウム+水 - 気体が発生する反応
塩酸+炭酸水素ナトリウム→
塩化ナトリウム+水+二酸化炭素 - 気体と結びつく反応
銅+酸素→酸化銅
【実験】硫酸と水酸化バリウムの反応|沈殿ができる
本章で学べる内容は次のとおりです。
本章で学べる内容
- 硫酸と水酸化バリウムの性質
- 硫酸と水酸化バリウムの実験の手順
- 硫酸と水酸化バリウムの実験の結果
- 硫酸と水酸化バリウムの実験の考察
- 硫酸と水酸化バリウムの化学反応式
硫酸と水酸化バリウムの性質
硫酸は酸性の無色透明の水溶液で、化学式はH₂SO₄です。
硫酸と鉄などの金属が反応すると、水素が発生します。
塩酸は気体の塩化水素が水にとけたものですが、硫酸は硫酸自体が液体です。
水酸化バリウムは白色の粉末で、化学式はBa(OH)₂です。
水酸化バリウムを水にとかしたものが、水酸化バリウム水溶液です。
水酸化バリウム水溶液はアルカリ性です。
酸性の硫酸と、アルカリ性の水酸化バリウム水溶液が反応すると、中和反応を示します。
硫酸と水酸化バリウムの実験の手順
硫酸と水酸化バリウムの実験の手順は、次のとおりです。
硫酸と水酸化バリウムの実験の手順
- 硫酸を入れたビーカーと水酸化バリウム水溶液を入れたビーカーの質量を、容器ごとはかる
- 2つの水溶液を混ぜ合わせ、反応のようすを観察する
- 反応後の全体の質量をはかる
硫酸と水酸化バリウムの実験の結果
硫酸と水酸化バリウムの実験の結果は、次のとおりです。
硫酸と水酸化バリウムの実験の結果
- 沈殿ができる
- 反応前後の全体の質量は変わらない
硫酸と水酸化バリウムの実験の考察
硫酸と水酸化バリウムの実験の考察は、次のとおりです。
硫酸と水酸化バリウムの実験の考察
- 化学変化の前後で、物質全体の質量は変わらないと考えられる
[理由]化学変化により、原子の組み合わせが変わるが、原子の数は変化しないから - 発生した白い沈殿は硫酸バリウムという固体である。化学変化により気体が発生したり、空気中の酸素と結びついたりしないため、フタがないのに質量が変わらない。
硫酸と水酸化バリウムの化学反応式
硫酸と水酸化バリウムの反応の化学反応式は、次のとおりです。
硫酸と水酸化バリウムの反応の化学反応式
H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
硫酸+水酸化バリウム→硫酸バリウム+水
【実験】塩酸と炭酸水素ナトリウムの反応|中2理科 化学
本章で学べる内容は次のとおりです。
本章で学べる内容
- 塩酸と炭酸水素ナトリウムの性質
- 塩酸と炭酸水素ナトリウムの実験の手順
- 塩酸と炭酸水素ナトリウムの実験の結果
- 塩酸と炭酸水素ナトリウムの実験の考察
- 塩酸と炭酸水素ナトリウムの化学反応式
塩酸と炭酸水素ナトリウムの性質
塩酸は気体の塩化水素HClが水にとけた水溶液です。塩酸は酸性の無色透明の水溶液で、化学式はHClです。
塩酸と鉄などの金属が反応すると、水素が発生します。
炭酸水素ナトリウムは白色の粉末で、化学式はNaHCO₃です。
炭酸水素ナトリウムは、水にとけにくいです。
炭酸水素ナトリウムの水溶液は、弱いアルカリ性を示します。
酸性の塩酸と、アルカリ性の炭酸水素ナトリウムが反応すると、中和反応を示します。
塩酸と炭酸水素ナトリウムの実験の手順
塩酸と炭酸水素ナトリウムの実験の手順は、次のとおりです。
塩酸と炭酸水素ナトリウムの実験の手順
- 炭酸水素ナトリウムを容器に入れ、小容器に入れた塩酸を図のように置き、ふたをしめる
- 全体の質量を、容器ごとはかる
- 容器を傾けて2つの物質を混ぜ合わせ、反応のようすを観察し、反応後の全体の質量をはかる
- ふたをゆるめて、どのような現象が見られるかを観察し、反応後の全体の質量をはかる
塩酸と炭酸水素ナトリウムの実験の結果
塩酸と炭酸水素ナトリウムの実験の結果は、次のとおりです。
塩酸と炭酸水素ナトリウムの実験の結果
- 塩酸と炭酸水素ナトリウムが反応すると、シュワシュワと気体が発生する
- ふたをしめている間、反応前後の全体の質量は変わらない
- ふたをゆるめると、プシュッと音がする。ふたをゆるめたあとの全体の質量は減少する
塩酸と炭酸水素ナトリウムの実験の考察
塩酸と炭酸水素ナトリウムの実験の考察は、次のとおりです。
塩酸と炭酸水素ナトリウムの実験の考察
- 化学変化の前後で、物質全体の質量は変わらないと考えられる
[理由]化学変化により、原子の組み合わせが変わるが、原子の数は変化しないから
※液体と固体から気体ができても質量は変化しない - ふたをゆるめるときに質量が減少したのは、化学変化により発生した気体が逃げたためだと考えられる
※発生した気体は二酸化炭素
塩酸と炭酸水素ナトリウムの化学反応式
塩酸と炭酸水素ナトリウムの反応の化学反応式は、次のとおりです。
塩酸と炭酸水素ナトリウムの反応の化学反応式
HCl+NaHCO₃→NaCl+H₂O+CO₂
塩酸+炭酸水素ナトリウム
→塩化ナトリウム+水+二酸化炭素
【実験】銅と酸素の反応|中2理科 化学
本章で学べる内容は次のとおりです。
本章で学べる内容
- 銅と酸素の実験の手順
- 銅と酸素の実験の結果
- 銅と酸素の実験の考察
- 銅と酸素の反応の化学反応式
銅と酸素が化学反応を起こすと、酸化銅ができます。
酸素と結びつく反応を、酸化と言います。下の記事で詳しく解説していますので、参考にしてください。
銅と酸素の実験の手順
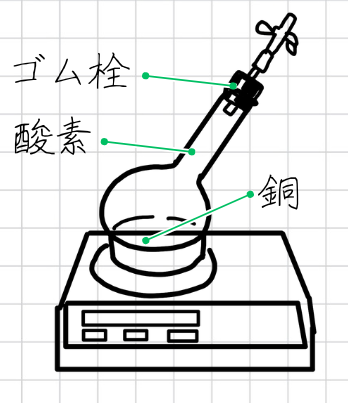
銅と酸素の実験の手順は、次のとおりです。
銅と酸素の実験の手順
- 丸底フラスコに酸素を満たし、銅の粉末を入れて、図の装置のようなゴム栓をしめる
- ゴム管のピンチコックをとじた状態で、容器全体の質量をはかる
- 加熱して、反応のようすを観察し、反応後の容器全体の質量をはかる
- ピンチコックを開き、容器全体の質量をはかる
銅と酸素の実験の結果
銅と酸素の実験の結果は、次のとおりです。
銅と酸素の実験の結果
- 赤色の銅は、反応後に黒色の物質に変化する
- ピンチコックをとじた状態では、質量が変化しない
- ピンチコックをひらくと、質量が増加する
銅と酸素の実験の考察
銅と酸素の実験の考察は、次のとおりです。
銅と酸素の実験の考察
- 銅は酸素と結びついて、酸化銅に変化する
- 化学変化の前後で、物質全体の質量は変わらないと考えられる
[理由]化学変化により、原子の組み合わせが変わるが、原子の数は変化しないから - ピンチコックをひらくと、質量が増加するのは、フラスコ内に空気が入ってくるため
銅と酸素の反応の化学反応式
銅の酸化の化学反応式は、次のとおりです。
銅の酸化の化学反応式
2Cu + O₂ → 2CuO
銅 +酸素 → 酸化銅
【まとめノート】質量保存の法則はフタがあるかないか|中2理科 化学
本記事では、中学2年の化学分野「質量保存の法則」を解説しました。
質量保存の法則とは、化学変化の前後で、反応に関係する物質全体の質量は変わらないという法則です。
化学変化の前後で、物質をつくる原子の組み合わせは変化するが、原子の種類と数は変わりません。
質量保存の法則を確かめるために、中学理科では次の3つの実験がよく出てきます。
質量保存の法則を確かめるための実験
- 硫酸バリウム沈殿ができる反応
硫酸+水酸化バリウム→
硫酸バリウム+水 - 二酸化炭素が発生する反応
塩酸+炭酸水素ナトリウム→
塩化ナトリウム+水+二酸化炭素 - 銅の酸化反応
銅+酸素→酸化銅
硫酸と水酸化バリウムから硫酸バリウム沈殿ができる反応を、下のノートにまとめました。参考にしてください。
![]()

気体がかかわる反応を、下にまとめました。実験はノートにまとめることで、理解しやすくなります。
![]()
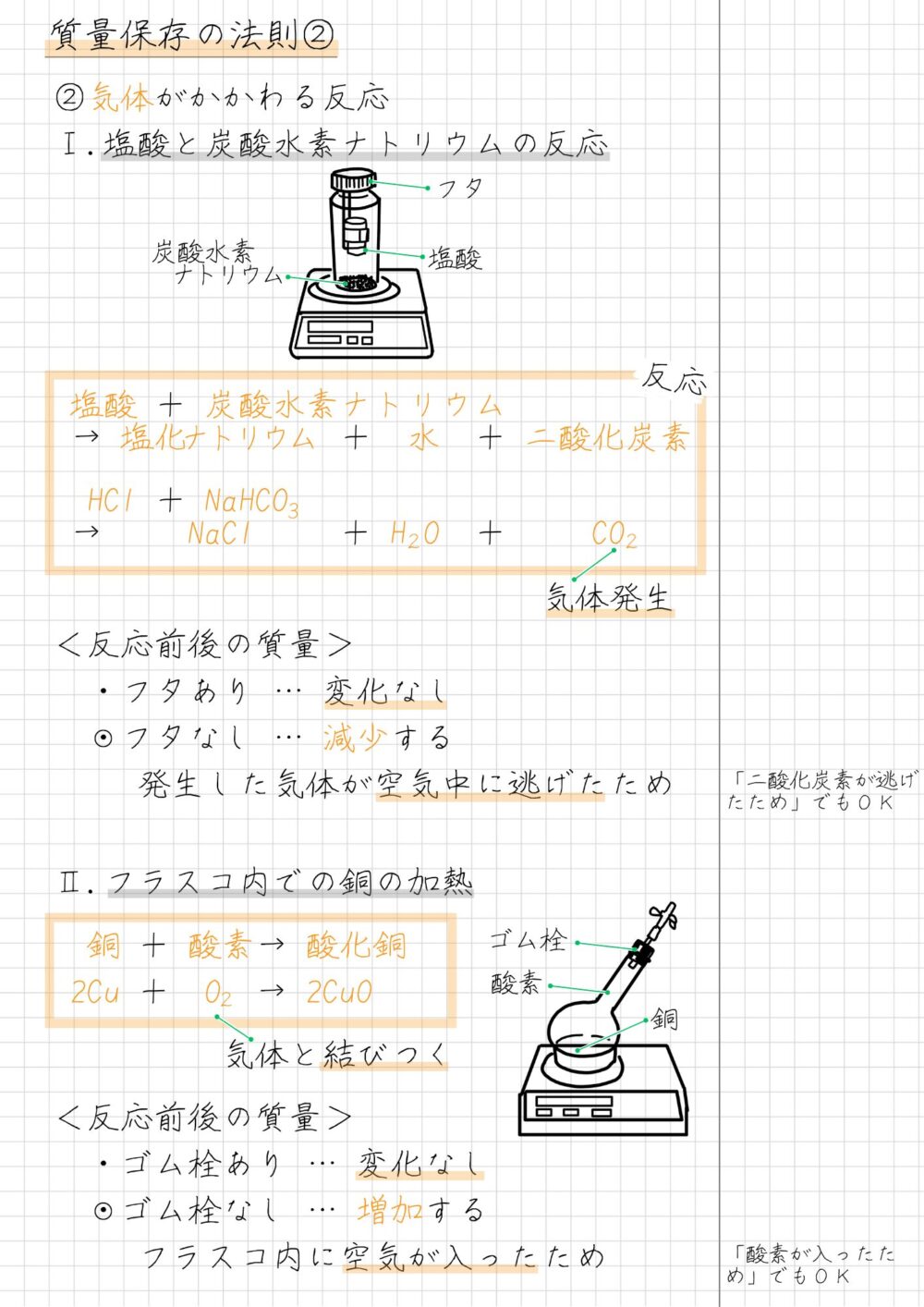
以上「質量保存の法則」の解説でした。
炭酸水素ナトリウムの化学反応について、復習したい方は、下の記事を参考にしてください▼


物質が結びつく化学反応について、学びたい方は下の記事が参考になります▼


酸化と燃焼の学習内容を忘れてお困りの方は、下の記事で学習してください▼








