この記事では、中学理科の現役教員けいが、理科を苦手な方でも理解できるように、中2理科の化学分野『酸化と還元』を解説します。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。還元について根本的に理解したい方は、ぜひ最後までお読みください。
還元と酸化のちがい|中2理科 化学
本章では、還元と酸化のちがいを、次の項目にそって解説します。
本章で学べる内容
- 還元は酸化物から酸素をとり除く化学変化
- 酸化は物質に酸素が結びつく化学変化
- 酸化と還元は同時に起こる化学変化
- 酸化されやすい物質は炭素と水素
本記事では、還元の内容がメインとなっていますので、酸化をもっと学習したい方は、次の記事を参考にしてください。
還元は酸化物から酸素をとり除く化学変化
物質(酸化物)から酸素がとり除かれたとき、その物質は還元されたと言います。
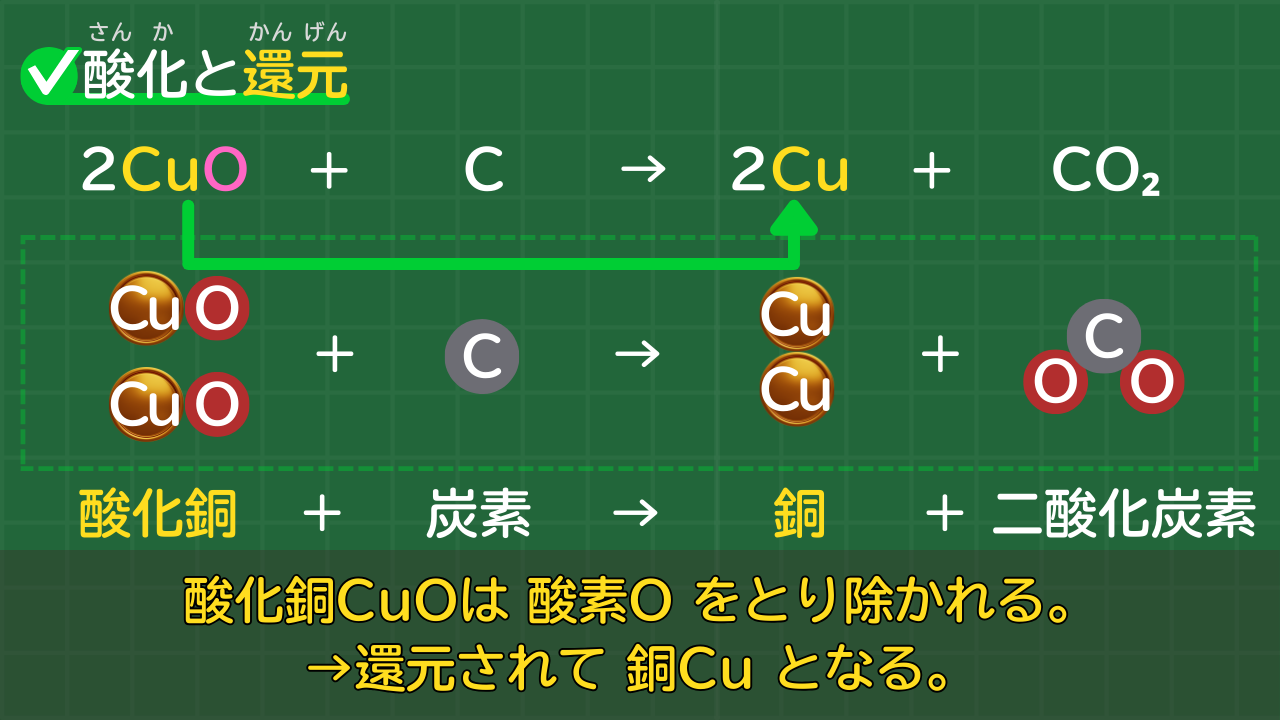
酸化銅と炭素の化学反応を例に考えてみましょう。
酸化銅と炭素の化学反応
2CuO + C → 2Cu + CO₂
酸化銅+炭素→銅+二酸化炭素
化学反応のあと、酸化銅は銅に変化しています。酸化銅の酸素がとり除かれたのです。
酸化は物質に酸素が結びつく化学変化
物質が酸素と結びついたとき、その物質は酸化されたと言います。
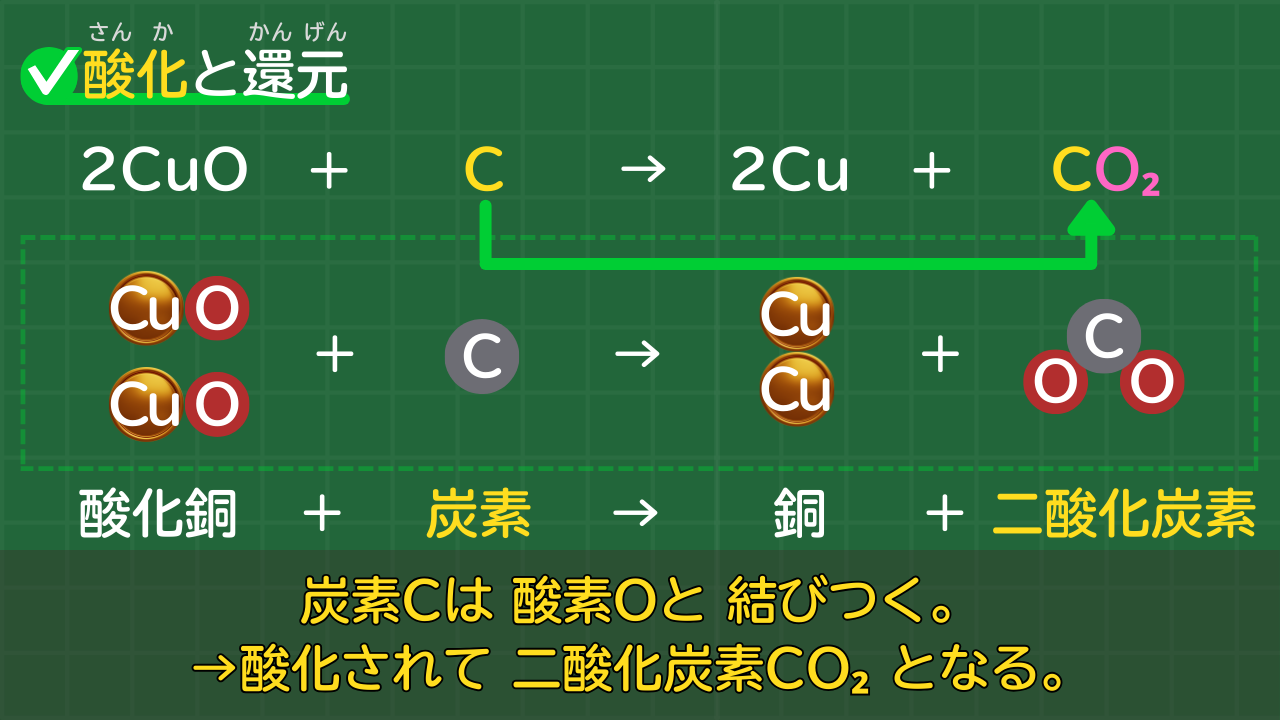
酸化銅と炭素の化学反応を例に考えてみましょう。
酸化銅と炭素の化学反応
2CuO + C → 2Cu + CO₂
酸化銅+炭素→銅+二酸化炭素
化学反応のあと、炭素は二酸化炭素に変化しています。炭素に酸素が結びついたのです。
酸化と還元は同時に起こる化学変化
酸化と還元は、同時に起きる現象です。
一方の物質が酸化されたら、もう一方の物質は還元されます。
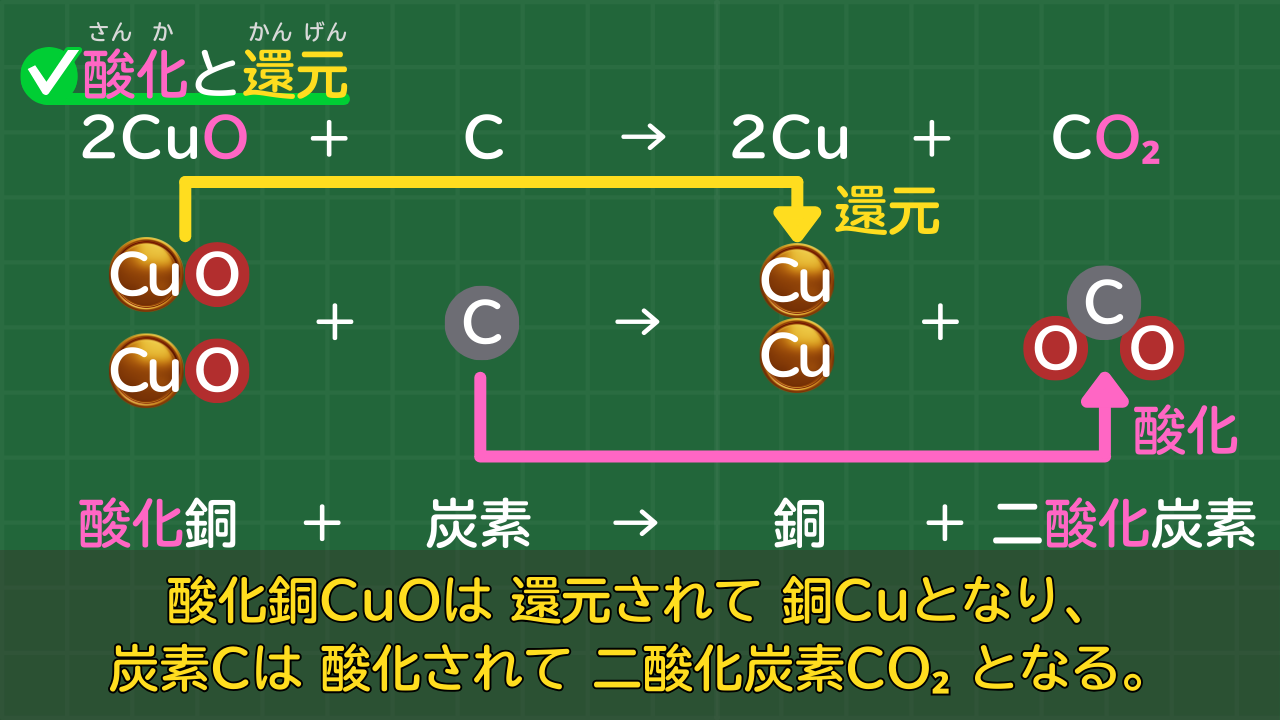
酸化銅と炭素の化学反応を例に考えてみましょう。
酸化銅と炭素の化学反応
2CuO + C → 2Cu + CO₂
酸化銅+炭素→銅+二酸化炭素
酸化銅と炭素の化学反応を、酸化と還元について解説すると、次のように言えます。
「酸化銅+炭素→銅+二酸化炭素」から分かること
- 酸化銅CuOは、還元されて銅となる
- 炭素Cは、酸化されて二酸化炭素CO₂となる
- 酸化と還元は、同時に起きる
酸化されやすい物質は炭素と水素
炭素や水素、エタノールは酸化されやすい物質です。
炭素が酸化されると二酸化炭素CO₂を生じ、水素が酸化されると水H₂Oを生じます。
酸化銅を還元する例を3パターンで考えてみましょう。
酸化銅の還元方法3パターン
- 酸化銅+炭素→銅+二酸化炭素
2CuO + C → 2Cu + CO₂ - 酸化銅+水素→銅+水
CuO + H₂ → Cu + H₂O - 酸化銅+エタノール→銅+アセトアルデヒド+水
CuO + C₂H₅OH → Cu + CH₃CHO + H₂O
銅よりも炭素、水素、エタノールの方が酸素と結びつきやすいため、銅が還元できるのです。
銅よりも炭素の方が酸化しやすいですが、実はマグネシウムの方が炭素より酸化しやすいです。
マグネシウムの酸化されやすさを比べるには、マグネシウムと二酸化炭素の化学反応について考えるといいでしょう。
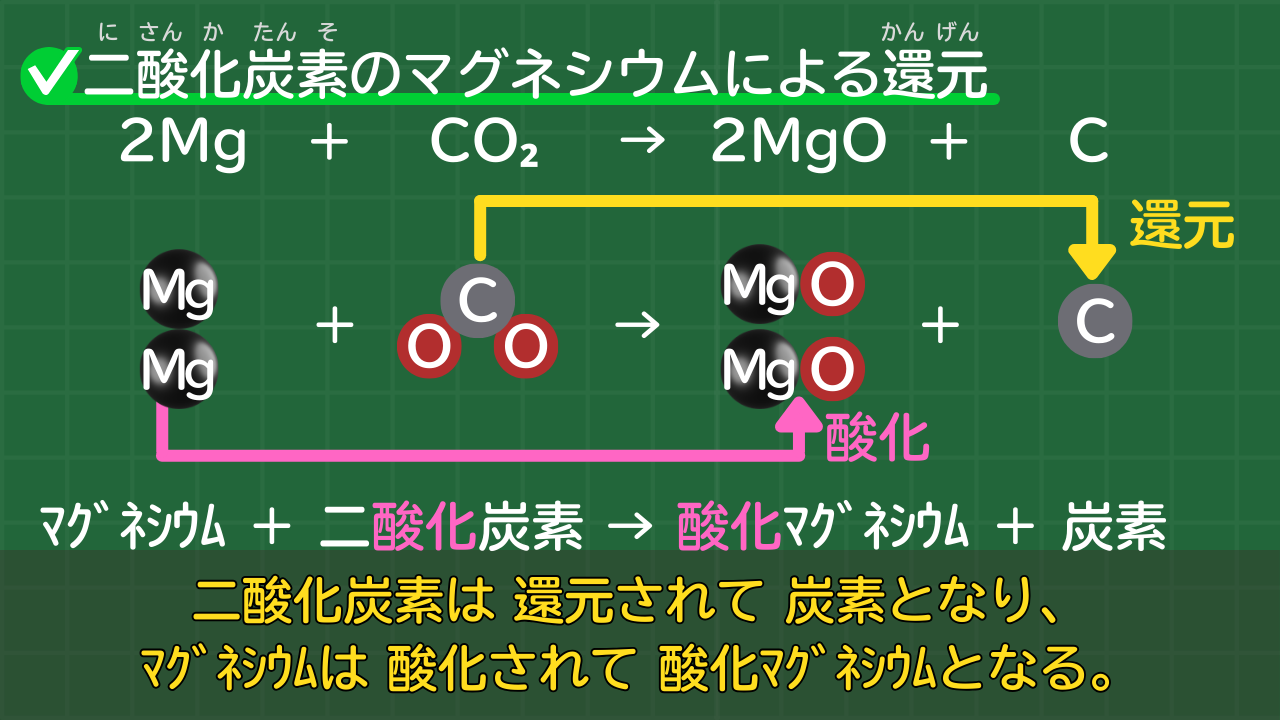
実は、マグネシウムは、二酸化炭素の入った集気びんに入れても燃焼します。下に、化学反応式を示します。
マグネシウムと二酸化炭素の化学反応
マグネシウム+二酸化炭素→酸化マグネシウム+炭素
2Mg + CO₂ → 2MgO + C
上記の化学反応から分かることは、マグネシウムが二酸化炭素中の酸素を奪ったということです。
つまり、炭素よりもマグネシウムの方が酸化されやすいことが分かります。
次に、炭素と銅の酸化されやすさを比べます。酸化銅と炭素の化学反応から考えます。
酸化銅と炭素の化学反応
酸化銅+炭素→銅+二酸化炭素
2CuO + C → 2Cu + CO₂
上記より、炭素は酸化銅の中の酸素を奪ったと言えます。つまり、銅よりも炭素の方が酸化されやすいです。
マグネシウムと銅の酸化されやすさをまとめると、次のように言えます。
マグネシウムと銅の酸化されやすさのまとめ
- マグネシウムは炭素よりも酸化しやすい
- 炭素は銅よりも酸化しやすい
上記より、マグネシウムと銅の酸化しやすさを比べると、次のように結論を出せます。
マグネシウムと銅の酸化しやすさの比較
マグネシウム > 炭素 > 銅
銅よりもマグネシウムの方が酸化しやすいことが分かります。
【実験】酸化銅の炭素による還元|2CuO+C→2Cu+CO₂
本章では、酸化銅と活性炭(粉末)を加熱する実験をとおして「酸化銅の炭素還元」について解説します。
本章では、次の内容が学べます。
本章で学べる内容
- 酸化銅の炭素還元の手順
- 酸化銅の炭素還元の注意点
- 酸化銅の炭素還元の結果
- 酸化銅の炭素還元の考察
- 酸化銅の炭素還元の化学反応式
酸化銅の炭素還元の手順
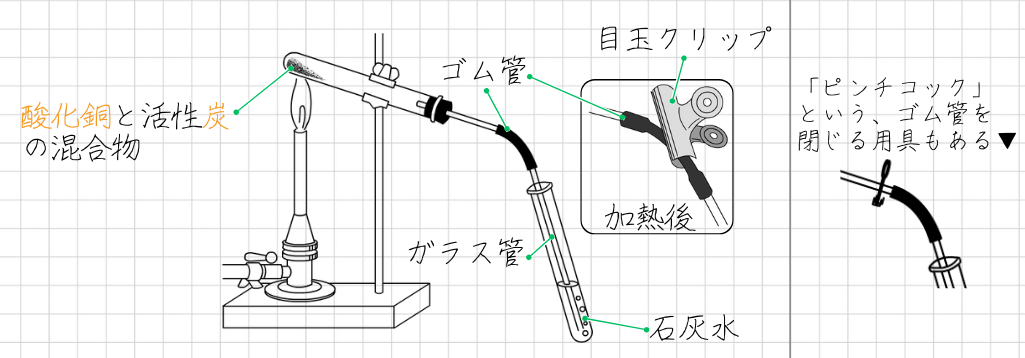
酸化銅の炭素還元の手順は、次のとおりです。
酸化銅の炭素還元の手順
- 酸化銅と活性炭を混ぜ合わせ、反応前に色や光沢を調べる
- 酸化銅と活性炭の混合物を試験管に入れる
- 図のような装置を組む
- 試験管を加熱し、石灰水の変化を観察する
- 反応が終わったら、ガラス管を石灰水から引き抜いてから火を消す。
- 火を消してから、目玉クリップでゴム管をとじる
- 加熱後の物質を、薬さじの裏側でこすり、色の変化や光沢を調べる
※目玉クリップはピンチコックの代わりにつかっている
酸化銅の炭素還元の注意点
酸化銅の炭素還元では、次のような点に注意しましょう。
酸化銅の炭素還元の注意点と理由
- 火を消す前に、ガラス管を石灰水から引き抜いておく
[理由]石灰水が試験管に逆流するのを防ぐため - 火を消した後、目玉クリップでゴム管をとじる
[理由]空気が試験管に吸い込まれるのを防ぐため
※空気は酸素でもOK
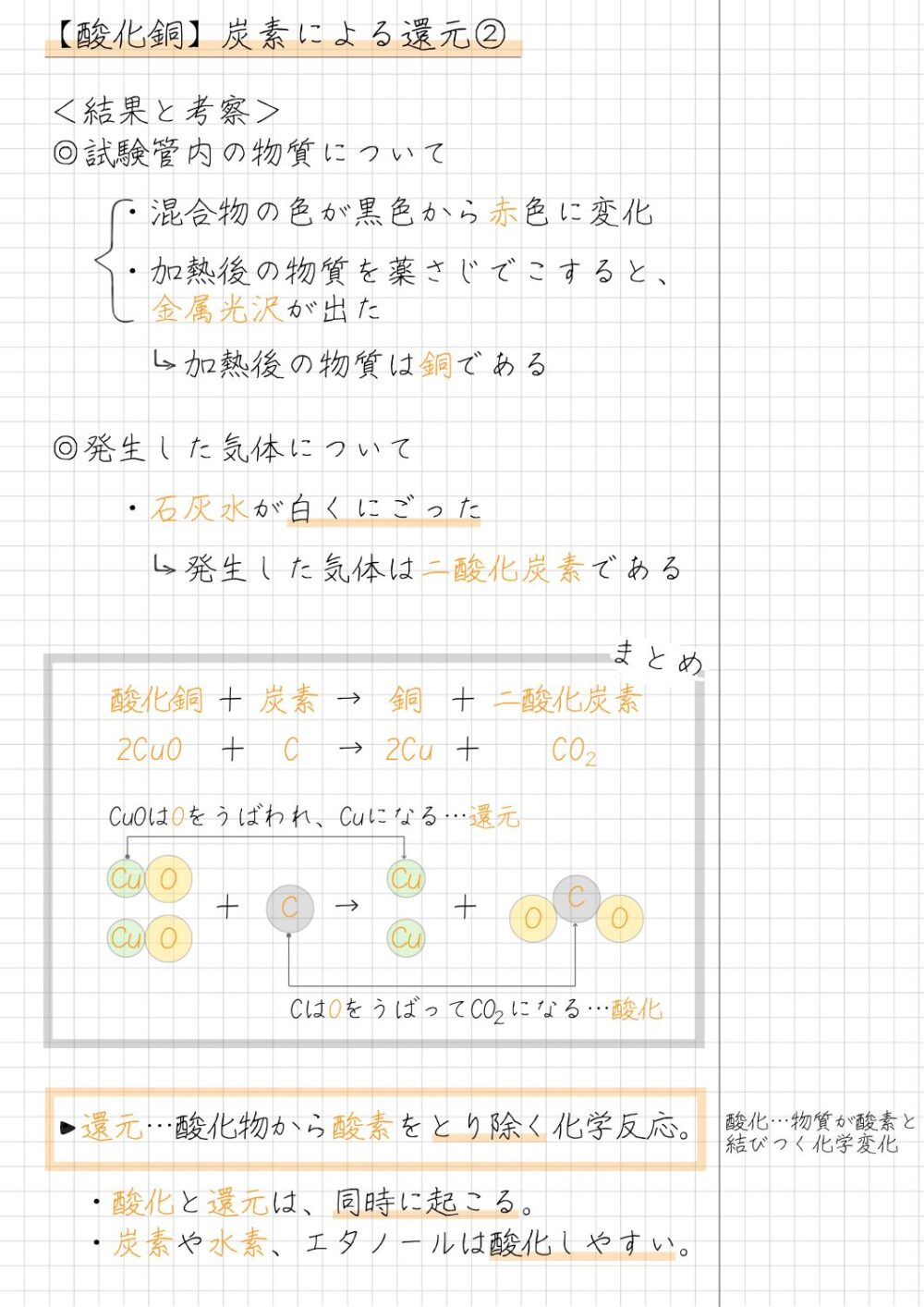
酸化銅の炭素還元の結果
酸化銅の炭素還元の結果は、次のとおりです。
酸化銅の炭素還元の結果
- 混合物の色が、黒色から赤色に変化した
- 加熱前に金属光沢がなかった混合物は、加熱後に薬さじでこすると、金属光沢が出た
- 石灰水が白くにごった
酸化銅の炭素還元の考察
酸化銅の炭素還元における考察と理由は、次のとおりです。
酸化銅の炭素還元における考察と理由
- 酸化銅と活性炭の混合物を加熱すると、銅ができることが分かる
[理由]加熱後の物質は赤色になり、金属光沢があるため - 酸化銅と活性炭の混合物を加熱すると、二酸化炭素が発生することが分かる
[理由]発生した気体と反応して、石灰水が白くにごるから
酸化銅の炭素還元の化学反応式
酸化銅の炭素還元の化学反応式は、次のとおりです。
酸化銅の炭素による還元の化学反応式
2CuO + C → 2Cu + CO₂
酸化銅+炭素→銅+二酸化炭素
【実験】酸化銅の水素による還元|CuO+H₂→Cu+H₂O
本章では、酸化銅(加熱した銅線)と水素を加熱する実験をとおして「酸化銅の水素還元」について解説します。
本章では、次の内容が学べます。
本章で学べる内容
- 酸化銅の水素還元の手順
- 酸化銅の水素還元の注意点
- 酸化銅の水素還元の結果
- 酸化銅の水素還元の考察
- 酸化銅の水素還元の化学反応式
酸化銅の水素還元の手順
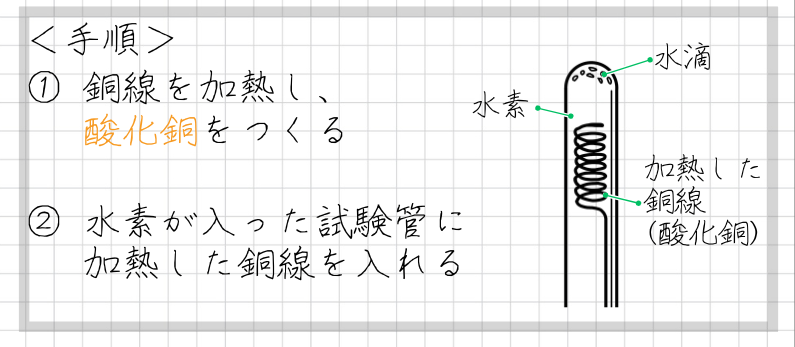
酸化銅の水素還元の手順は、次のとおりです。
酸化銅の水素還元の手順
- 銅線を空気中で加熱し、酸化銅に変化させ、色や光沢を調べる
- 加熱後の酸化銅を、水素が入れて口を下に向けた試験管に入れる
- 試験管内の酸化銅の反応のようすを観察する
- 反応後の酸化銅の色の変化や光沢を調べる
- 試験管内の内側についた水滴に、青色の塩化コバルト紙をつけて色の変化を見る
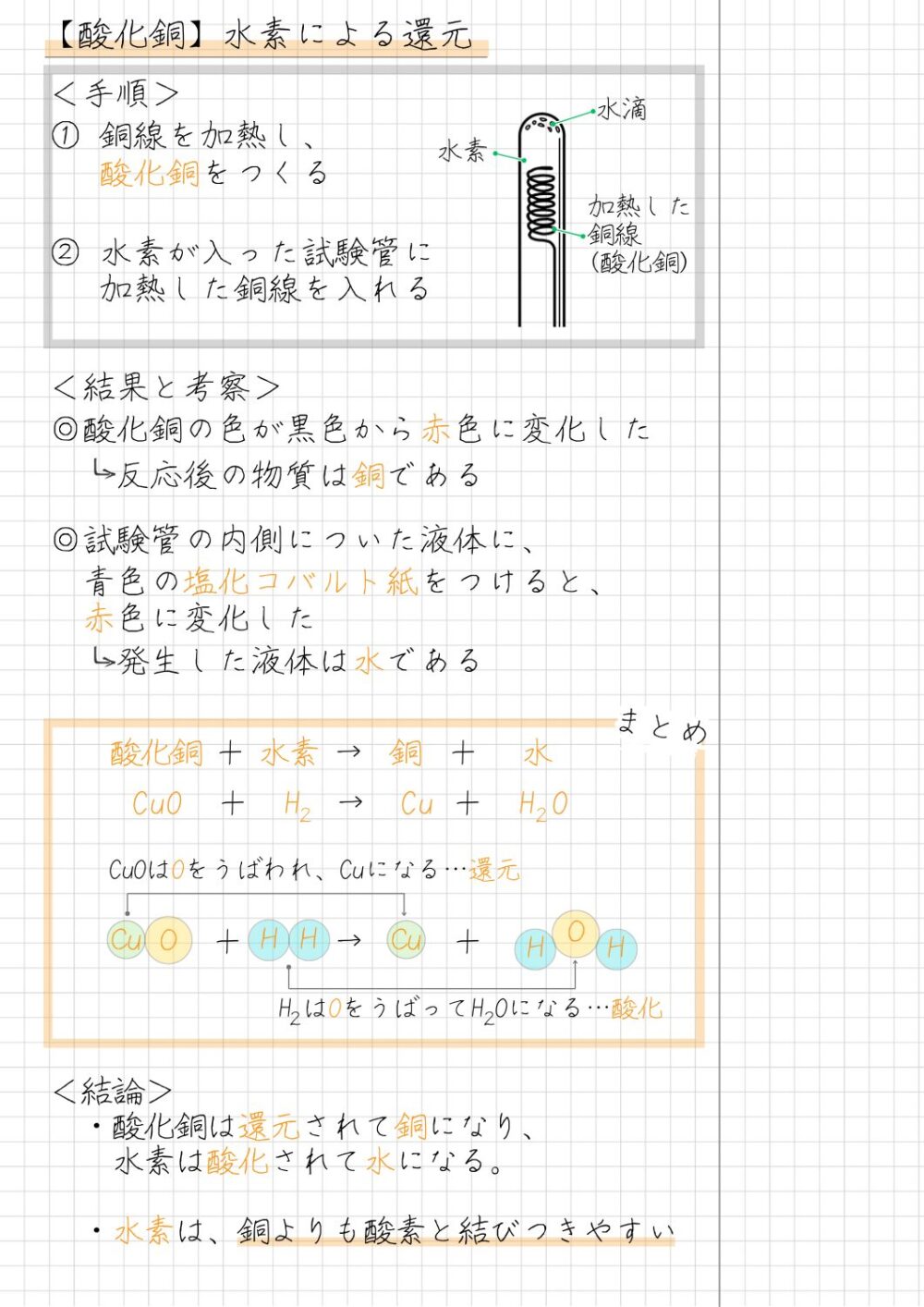
酸化銅の水素還元の結果
酸化銅の水素還元の結果は、次のとおりです。
酸化銅の水素還元の結果
- 混合物の色が、黒色から赤色に変化した
- 加熱前に金属光沢がなかった混合物は、加熱後に薬さじでこすると、金属光沢が出た
- 試験管の内側に液体がついた
- 試験管内の内側についた液体に、青色の塩化コバルト紙をつけると、赤色に変化した
酸化銅の水素還元の考察
酸化銅の水素還元における考察と理由は、次のとおりです。
酸化銅の水素還元の考察と理由
- 酸化銅と水素が反応すると、銅ができることが分かる
[理由]加熱後の物質は赤色になり、金属光沢があるため - 酸化銅と水素が反応すると、水が発生することが分かる
[理由]発生した液体と反応して青色の塩化コバルト紙が赤色になるから
酸化銅の水素還元の化学反応式
酸化銅の水素還元の化学反応式は、次のとおりです。
酸化銅の水素による還元の化学反応式
CuO + H₂ → Cu + H₂O
酸化銅+水素→銅+水
【実験】二酸化炭素のマグネシウム還元|中2理科 化学
本章では、マグネシウムを二酸化炭素中で燃やす実験をとおして「二酸化炭素のマグネシウム還元」について解説します。
本章では、次の内容が学べます。
本章で学べる内容
- 二酸化炭素のマグネシウム還元の手順
- 二酸化炭素のマグネシウム還元の注意点
- 二酸化炭素のマグネシウム還元の結果
- 二酸化炭素のマグネシウム還元の考察
- 二酸化炭素のマグネシウム還元の化学反応式
二酸化炭素のマグネシウム還元の手順
二酸化炭素のマグネシウム還元の手順は、次のとおりです。
二酸化炭素のマグネシウム還元の手順
- 空気中でマグネシウムリボンを燃焼させて、反応のようすを観察する。また、加熱後の物質を紙の上に置き、色などを調べる
- 集気びんに二酸化炭素を入れる
- 別のマグネシウムリボンに火をつけてから、集気びんに入れ、反応のようすを観察する。また、加熱後の物質を紙の上に置き、色などを調べる
二酸化炭素のマグネシウム還元の注意点
二酸化炭素のマグネシウム還元では、次のような点に注意しましょう。
二酸化炭素のマグネシウム還元の注意点と理由
マグネシウムリボンに火をつけてから、直接見続けないようにする
[理由]マグネシウムを燃やすと強い光が出るため
二酸化炭素のマグネシウム還元の結果
二酸化炭素のマグネシウム還元の結果は、次のとおりです。
二酸化炭素のマグネシウム還元の結果
- 空気中で燃焼させたあとは、物質が白くなり、金属光沢がなくなった
- 二酸化炭素中で燃焼させたあと、物質は白くなったが、表面に黒い固体がついた。金属光沢はなかった
二酸化炭素のマグネシウム還元の考察
二酸化炭素のマグネシウム還元における考察と理由は、次のとおりです。
二酸化炭素のマグネシウム還元の考察と理由
- 空気中でマグネシウムリボンを燃焼させると、マグネシウムが酸素と結びつき酸化マグネシウムができる
[理由]加熱後の物質が白くなり、金属光沢が見られないから - 二酸化炭素中でマグネシウムリボンを燃焼させると、酸化マグネシウムと炭素ができる
[理由]加熱後に白くなった物質の表面に、黒い固体がついたから
二酸化炭素のマグネシウム還元の化学反応式

二酸化炭素のマグネシウムによる還元の化学反応式は、次のとおりです。
二酸化炭素のマグネシウム還元の化学反応式
2Mg + CO₂ → 2MgO + C
マグネシウム+二酸化炭素→酸化マグネシウム+炭素
ちなみに、マグネシウムと酸素から酸化マグネシウムができる化学反応式は、次のとおりです。
マグネシウムと酸素から酸化マグネシウムができる化学反応式
2Mg + O₂ → 2MgO
マグネシウム+酸素→酸化マグネシウム
酸化銀の還元|中2理科 化学

「酸化銀の還元」は「酸化銀の熱分解」と同じ化学変化です。
酸化銀は、酸素との結びつきが非常に弱いため、加熱するだけで、酸素をとり除けます。
加熱するだけで酸素を取り除ける酸化銀に対して、酸化銅は炭素や水素などと反応させる必要があります。
酸化銀の熱分解は、次の記事を参考にしてください。
≫中2理科【化学変化】物質の熱分解を日本一分かりやすく解説!
酸化銀の還元(熱分解)の化学反応式は、次のとおりです。
酸化銀の還元(熱分解)の化学反応式
2Ag₂O → 4Ag + O₂
酸化銀 → 銀 + 酸素
【まとめノート】還元は整理するとカンタンに覚えられる!|中2理科 化学
本記事では、中2理科の化学分野『還元と酸化』について解説しました。
還元と酸化、化学反応について、下のまとめノートを参考にしてください。
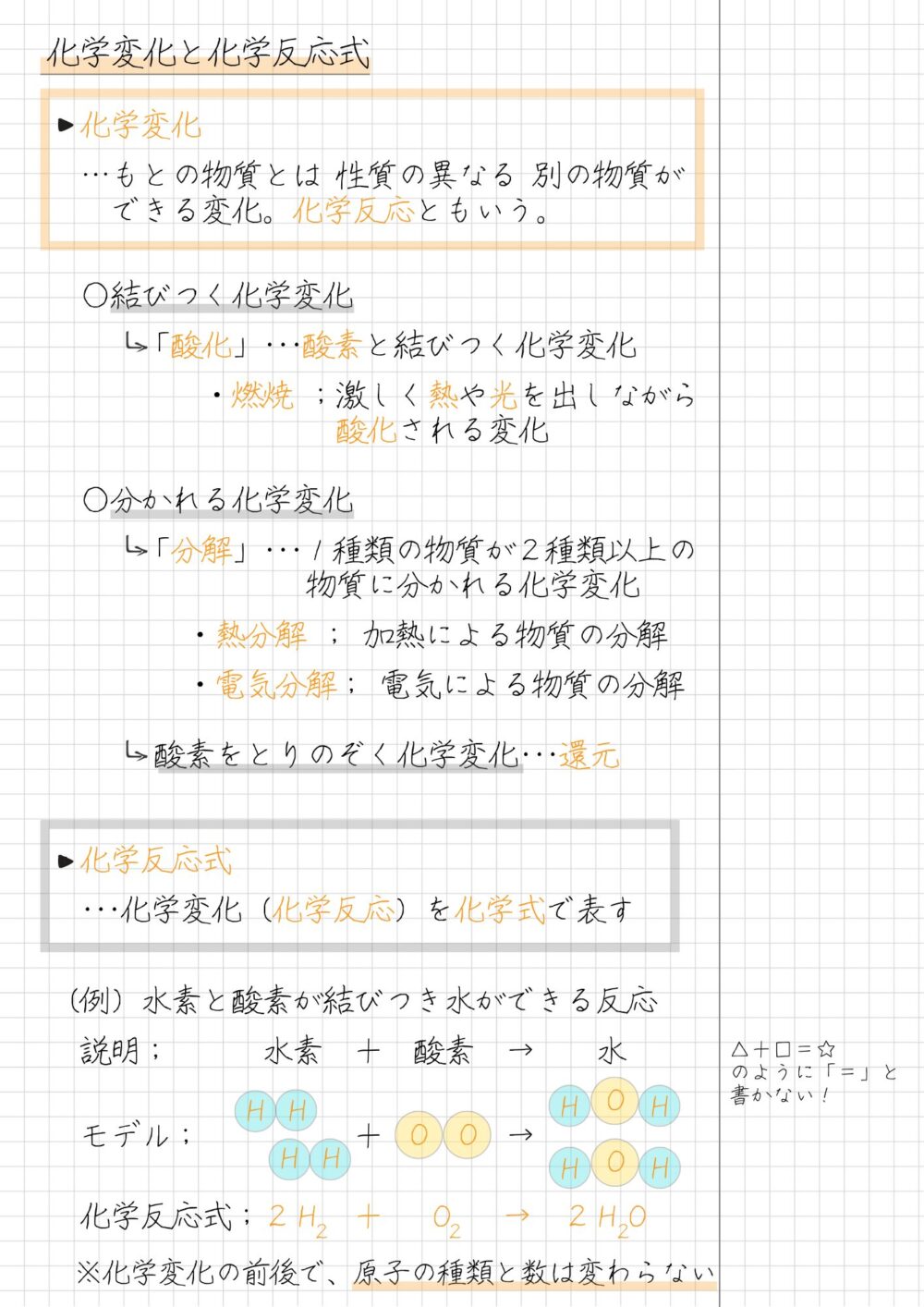
酸化銅の還元には、主に炭素や水素を用いる方法があります。
酸化銅の炭素による還元の実験を、下のまとめノートとして、分かりやすくまとめました。
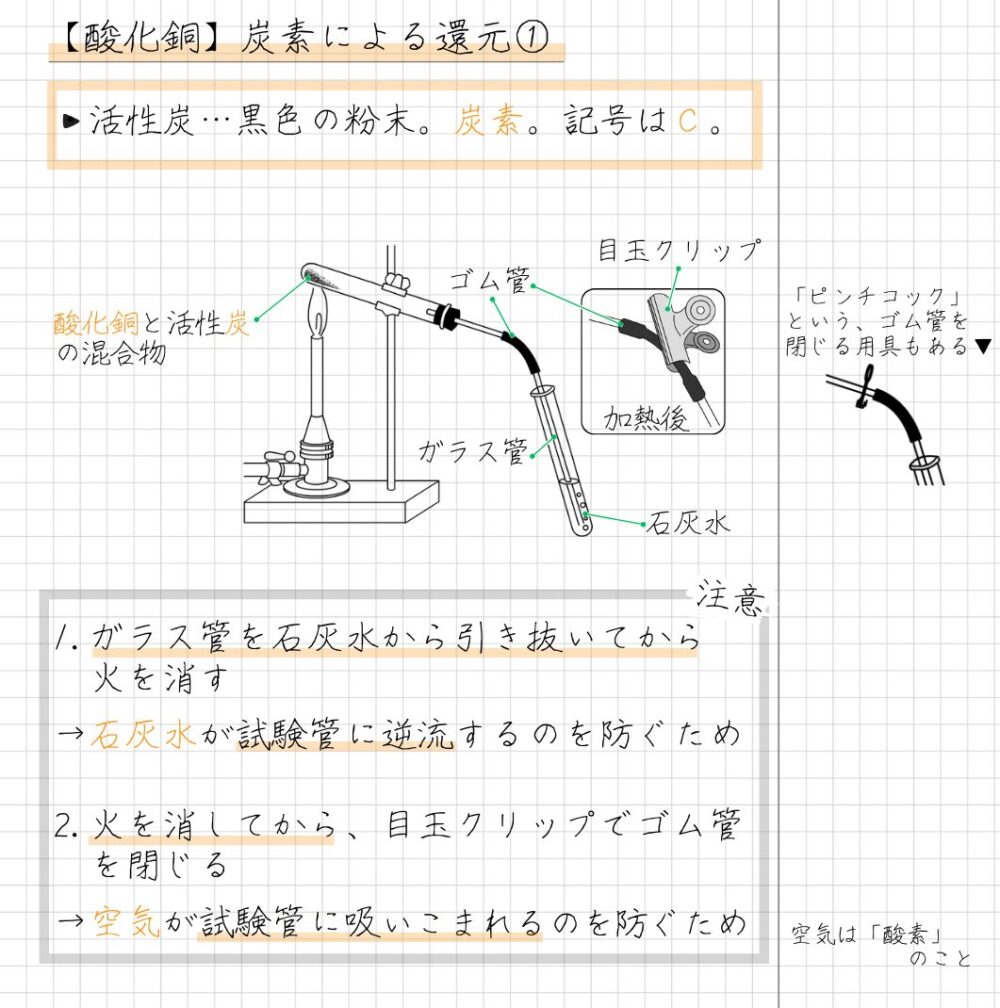
酸化銅の水素による還元の実験は、下のノートのようにまとめるといいでしょう。
以上『還元と酸化』の解説でした。
この記事では主に、還元を解説したので、酸化について学習したい方は、下の記事を参考にしてください。


下の記事では、中学2年生にとって、知っていて得する化学反応式をまとめています。


この記事が皆さんの深い学びにつながれば幸いです






