中学理科の現役教員けいが「中2理科の化学分野-化学反応式一覧–」を、誰よりも分かりやすく解説します。
この記事では、化学反応を一つ一つ図解により解説しているため、分子や原子をイメージしながら学習できます。理解しながら暗記すると、長期記憶にのこりやすいです。
私が17年かけて培ってきた塾講師・教員経験を凝縮しました。入試や定期テストに本当に出る化学反応式を覚えたい方は、ぜひ参考にしてください。
化学反応式とは
化学反応式は、化学反応(化学変化)を分かりやすく示したものです。
化学反応には、物質どうしが結びつくものや、分解して別の物質ができる変化などがあります。
中学理科で出てくる化学反応
- 結びつく反応
- 分解
- 酸化と還元
- 中和
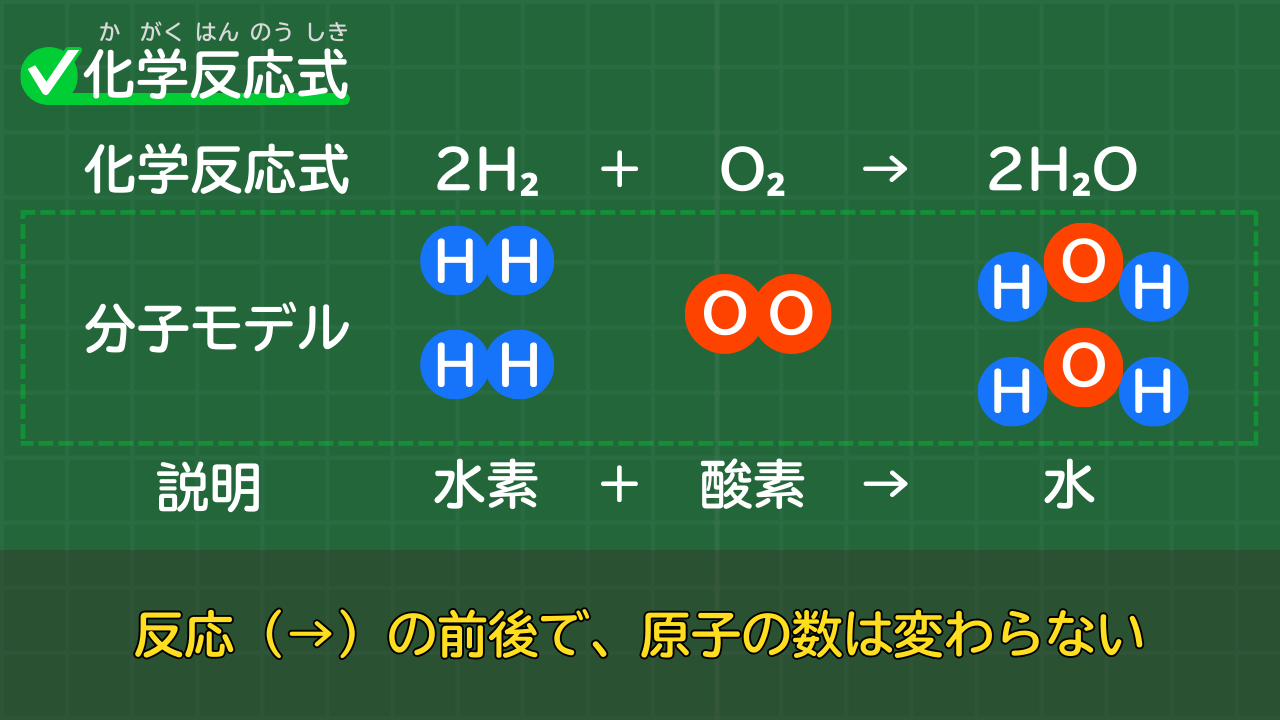
例として、水素と酸素が結びつき、水ができる化学変化の化学反応式を考えましょう。
「水素と酸素が結びつき、水ができる反応」を、理科的に言い換えると、次のように言えます。
水素 + 酸素 → 水
なお、上のような表現の仕方では、原子や分子の数が分かりません。
「水素と酸素が結びつき、水ができる」という化学変化を、化学反応式で示すと次のようになります。
水ができる反応
2H₂ + O₂ → 2H₂O
上の式を見ると、化学反応が起こる前後で、原子の数が変わらないことが分かります。
本章では、化学反応式における、次の2点についても解説します。
本章で学べる内容
- 化学反応式は化学変化を表す
- 化学反応式は化学式とはちがう
順番に解説します。
化学反応式は化学変化を表す
化学反応式は化学変化(化学反応)を、化学式や「+」、「→」で表す式です。
下のような化学反応を、化学反応式で表すことで、分子の数や原子どうしの結びつきが、理解しやすくなります。
化学変化と化学反応式
- 物質が結びつく反応 A+B → C
- 分解 A → B+C
- 還元 A+B → C+D
化学反応式は、数式とはちがい「=」ではなく「→」を使います。
化学反応式は化学式とはちがう
化学反応式とよく似た用語に化学式があります。
化学反応式と化学式は、下で示しているとおり、全くちがうものです。
化学式と化学反応式のちがい
化学式
元素記号と右下につける数字で物質を表す
化学反応式
化学式や「+」、「→」で化学反応を表す
例題を解いてみましょう▼
水の化学式はCO₂です。
酸化銅ができる化学反応式は
2Cu + O₂ → 2CuO
で表します。
化学反応式のつくり方【4ステップ】
化学反応式のつくり方は、次の4ステップです。
化学反応式のつくり方
- 化学式を覚える
- 物質名の反応式を覚える
- 化学反応式を覚える
- 左右の原子の数で確かめ算する
4つのステップを詳しく解説します。
1.化学式を覚える
化学反応式をつくるには、まず化学式を覚えておく必要があります。
中学2年のうちに覚えておくべき化学式は、下の解説記事にてまとめてあります。
化学反応式に必要なのは、元素記号ではなく化学式だからです。
何回も復習して、化学式を完ぺきに書けるようにしましょう。
化学式を覚えたら、次のステップ2にうつります。
2.物質名の反応式を覚える
化学式を覚えたら、物質名の反応式を覚えましょう。
物質名の反応式とは、次のようなものを指します。
物質名の反応式の例
- 酸化銀→酸素+銀
- 炭素+酸素→二酸化炭素
日本語版の化学反応式のようなもので、どのような化学反応が起こるのか、全体像がイメージしやすくなります。
中学2年で出てくる化学反応は、大きく分けて次の3パターンあります。
化学反応3パターン
- 結びつく反応; A+B → C
- 分解する反応;A → B+C
- 酸化と還元;A+B → C+D
物質名で反応式のイメージをつかんだら、次のステップ3にうつります。
3.化学反応式を覚える
物質名の反応式(日本語版の化学反応式)を覚えたら、化学式と「→」を使った化学反応式を覚えましょう。
化学反応式を覚えるときに、気をつけるポイントは次の3つです。
化学反応式を覚えるポイント
- イコール「=」ではなく矢印「→」をつかう
- 化学式の右下の数字に気をつける
- 化学式の左の数字(係数)に気をつける
4.左右の原子の数で確かめ算する
化学反応式を書いたら、必ず確かめ算をしましょう。
化学反応式の確かめ算のしかたは、次のとおりです。
化学反応式の確かめ算のしかた
- 矢印の左右の原子の数が等しいか確認する
※左右の原子の数が等しくなかったら
- 化合物の係数をいじる
- 単体の係数をいじる
- 「1」は省略する
手順1のとおり、化学反応式の確かめ算で初めにすることは、左右の原子の数を確かめることです。
化学反応式では、左右の原子の数が必ず等しくなります。
化学反応式の原子の数が等しくなければ、手順2から4を行って、正解を目指しましょう。
手順2.化合物の係数をいじる
左右の原子の数が等しくなければ、まず化合物の係数をいじってみましょう。
化合物の係数をいじるとは?
- 化合物とは、HClやCO₂のような、元素が2種類以上含まれている物質のこと
- 係数をいじるとは、化学式の左につける数字を変えること
- 元素が多く含まれている化合物の係数を先に変えておく方が、効率がいい
2H₂Oは、H₂Oが2つあるという意味です。
水素原子Hは4つ、酸素原子Oは2つあることが分かります。
3.単体の係数をいじる
化合物の係数をいじったら、続いて単体の係数をいじりましょう。
先に化合物の係数を変えるのは、化合物の方が係数を変える元素の種類が多いからです。
4.「1」は省略する
化学反応式では、数式と同じく係数「1」は省略する決まりになっています。
忘れずに、係数「1」を省略しましょう。
分解の化学反応式一覧|中2理科 化学
中学2年の理科でよく出る、分解の化学反応式は次のとおりです。
分解の化学反応式一覧
- 水の電気分解
2H₂O → 2H₂+O₂ - 塩酸の電気分解
2HCl → H₂+Cl₂ - 塩化銅の電気分解
CuCl₂ → Cu+Cl₂ - 酸化銀の熱分解
2Ag₂O → 4Ag+O₂ - 過酸化水素水の熱分解
2H₂O₂ → O₂+2H₂O - 炭酸水素ナトリウムの熱分解
2NaHCO₃ → Na₂CO₃+CO₂+H₂O
なお、分解とは、電気や熱などにより化学変化が起き、別の物質が生じる反応のことです。
本章では、日本語版化学反応式や分子モデルを用いて分かりやすく解説します。
【水の電気分解】2H₂O→2H₂+O₂
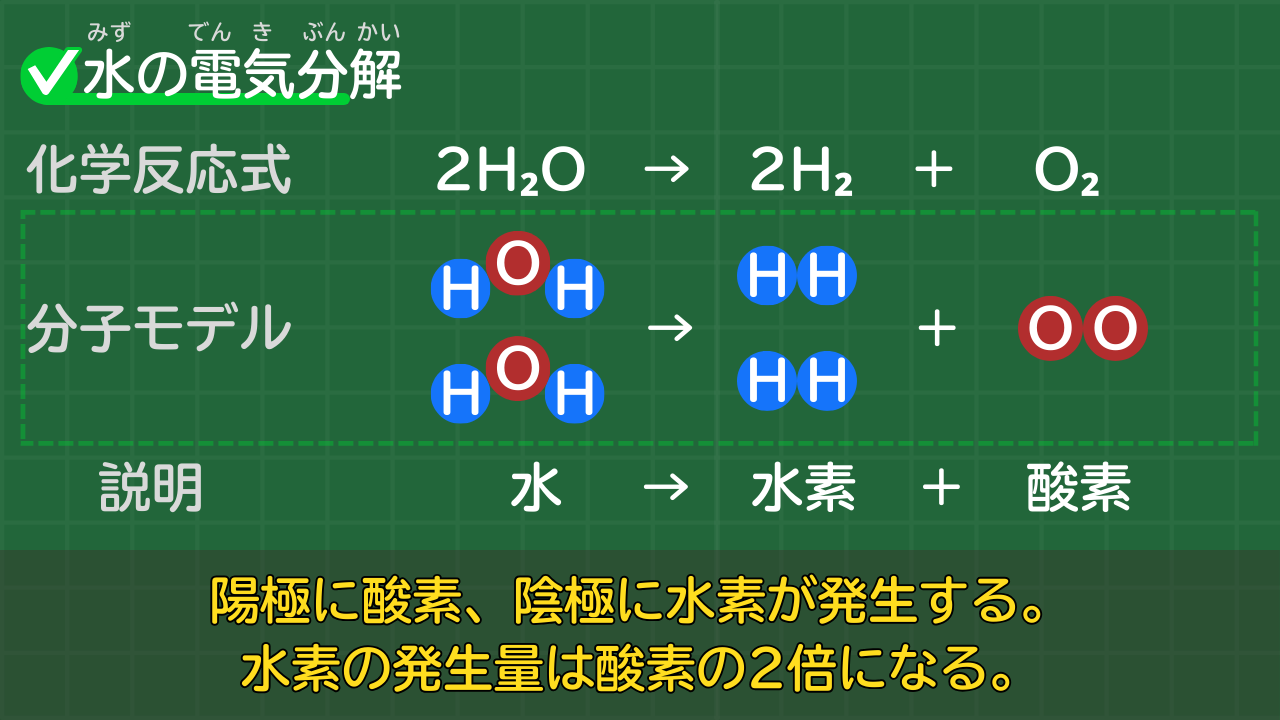
水は電気分解により、水素と酸素に分解されます。
水の電気分解の化学反応式
2H₂O → 2H₂ + O₂
(水→水素+酸素)
【塩酸の電気分解】2HCl→H₂+Cl₂
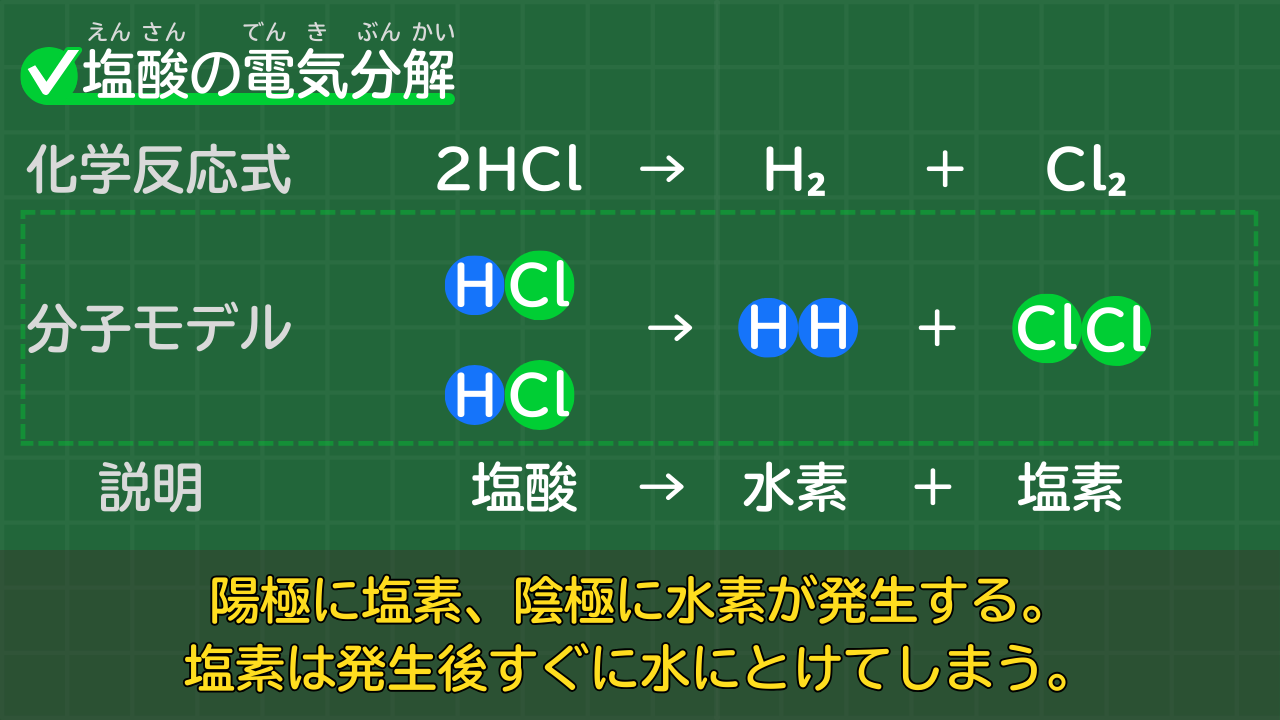
塩酸は電気分解により、水素と塩素に分解されます。
なお、塩酸は塩化水素HClが水に溶けた水溶液です。
塩酸の化学式は、塩化水素と同じく、HClです。
塩酸の電気分解の化学反応式は、次のとおりです。
塩酸の電気分解の化学反応式
2HCl → H₂ + Cl₂
(塩酸→水素+塩素)
【塩化銅の電気分解】CuCl₂→Cu+Cl₂
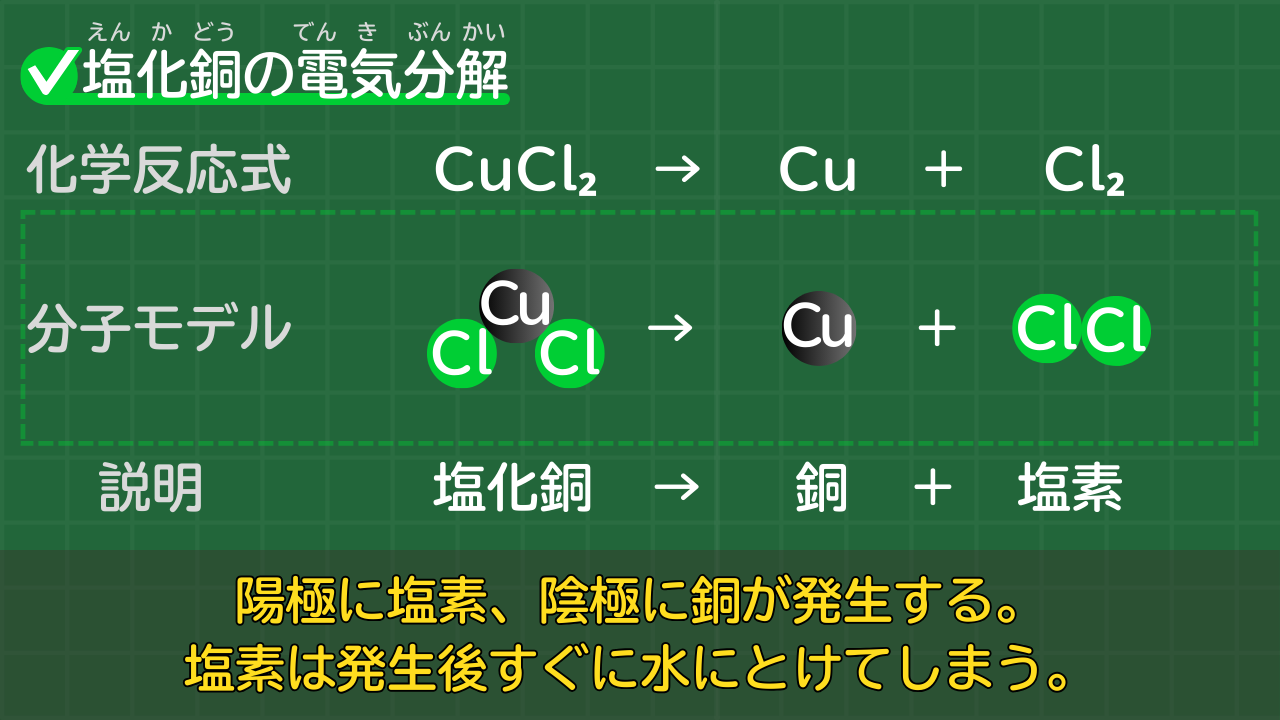
塩化銅は電気分解により、銅と塩素に分解されます。固体のままでは電流が通らないため、塩化銅水溶液を電気分解します。
塩化銅の電気分解の化学反応式は、次のとおりです。
塩化銅の電気分解の化学反応式
CuCl₂ → Cu + Cl₂
(塩化銅→銅+塩素)
銅は固体として出てきます。電極に赤茶色の物質がつくことで、発生しているようすを見られます。
塩素は気体として発生しますが、すぐに水にとけてしまいます。塩素が水にとけた液には、漂白作用が確認できます。
【酸化銀の熱分解】2Ag₂O→4Ag+O₂

酸化銀は熱分解により、銀と酸素に分解されます。
酸化銀の熱分解の化学反応式は、次のとおりです。
酸化銀の熱分解の化学反応式
2Ag₂O→4Ag+O₂
(酸化銀 → 銀 + 酸素)
【過酸化水素水の熱分解】2H₂O₂→O₂+2H₂O
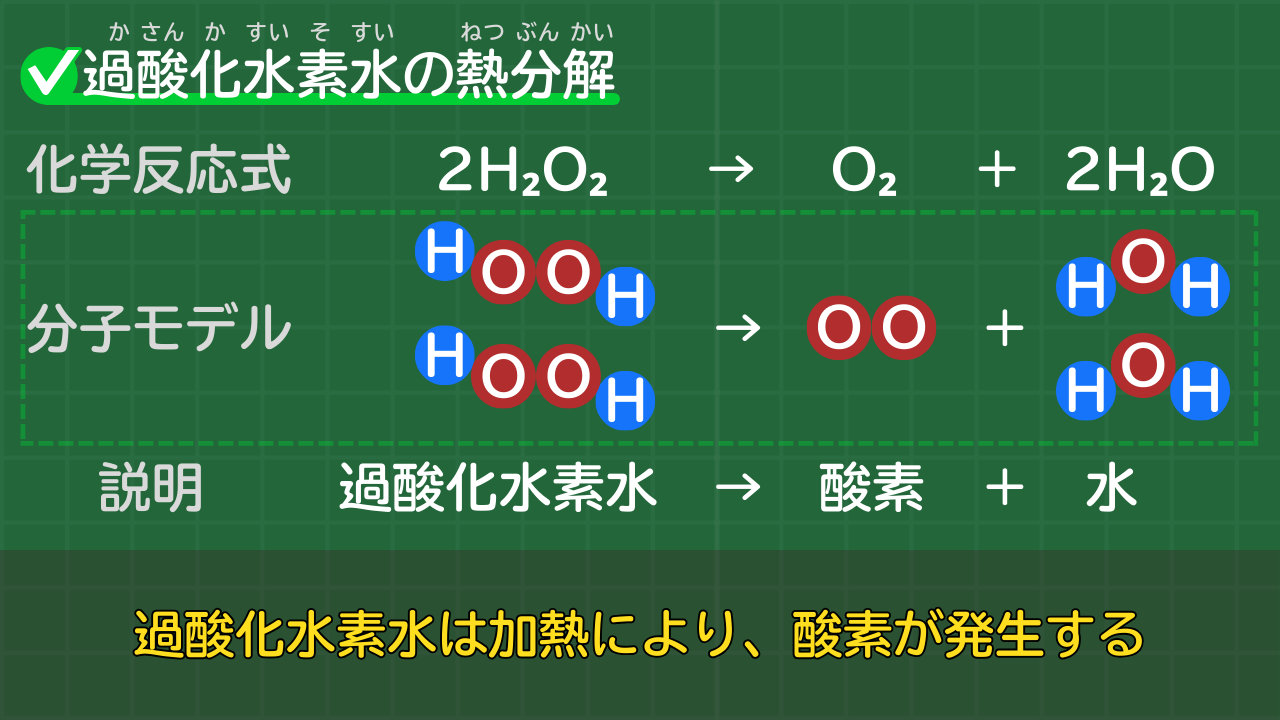
過酸化水素水は熱分解により、酸素と水に分解されます。
過酸化水素水の熱分解の化学反応式は、次のとおりです。
過酸化水素水の熱分解の化学反応式
2H₂O₂ → O₂+2H₂O
(過酸化水素水→酸素+水)
【炭酸水素ナトリウムの熱分解】2NaHCO₃→Na₂CO₃+CO₂+H₂O
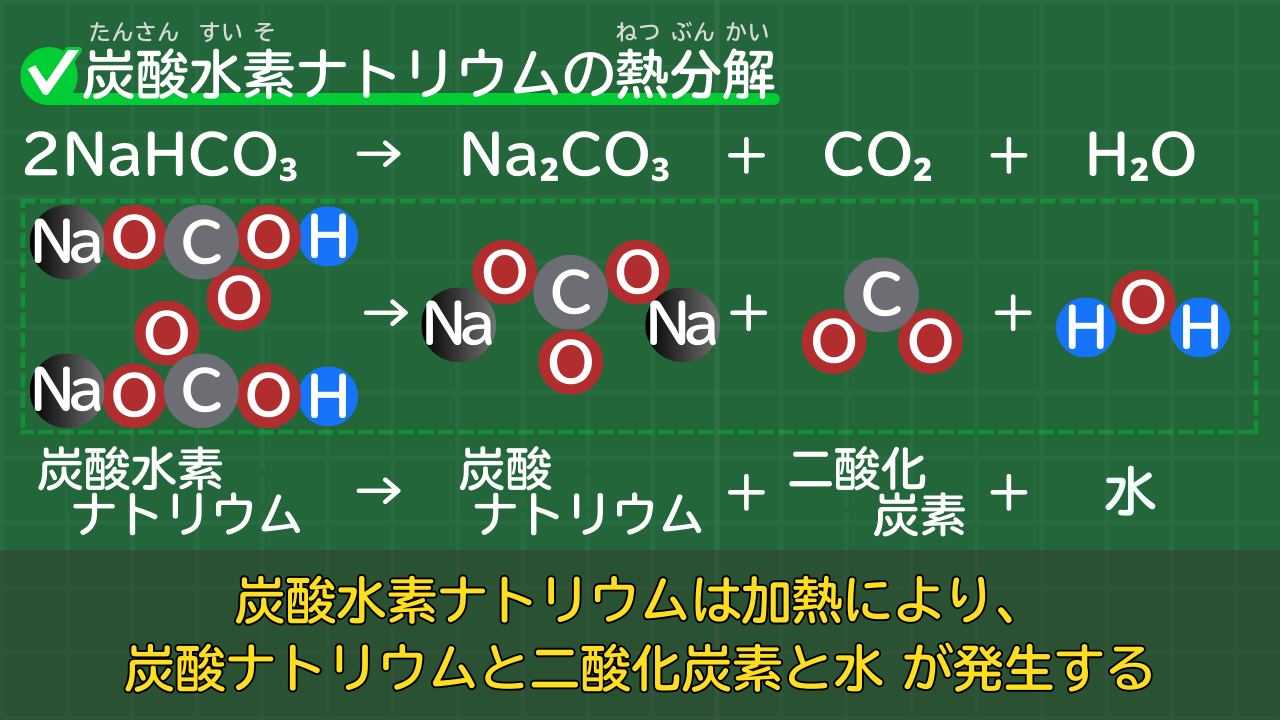
炭酸水素ナトリウムは熱分解により、次の3つの物質が発生します。
炭酸水素ナトリウムの熱分解で発生する物質
- 白い粉末の炭酸ナトリウム
- 気体の二酸化炭素
- 液体の水
炭酸水素ナトリウムの熱分解の化学反応式は次のとおりです。
炭酸水素ナトリウムの熱分解の化学反応式
2NaHCO₃→Na₂CO₃+CO₂+H₂O
(炭酸水素ナトリウム→炭酸ナトリウム+二酸化炭素+水)
結びつく化学反応式一覧|中2理科 化学
中学2年の理科でよく出る、物質が結びつく化学反応式は次のとおりです。
物質が結びつく化学反応式一覧
- 水ができる反応
2H₂+O₂→2H₂O - 二酸化炭素ができる反応
C+O₂→CO₂ - 酸化銅ができる反応
2Cu+O₂→2CuO - マグネシウムの燃焼
2Mg+O₂→2MgO - 塩化銅ができる反応
Cu+Cl₂→CuCl₂ - 硫化鉄ができる反応
Fe+S→FeS - 硫化銅ができる反応
Cu+S→CuS
結びつく化学変化では、物質どうしが化学的に結びつき、別の物質が生じます。
本章では、日本語版化学反応式や分子モデルを用いて分かりやすく解説します。
酸化【水ができる反応】2H₂+O₂→2H₂O
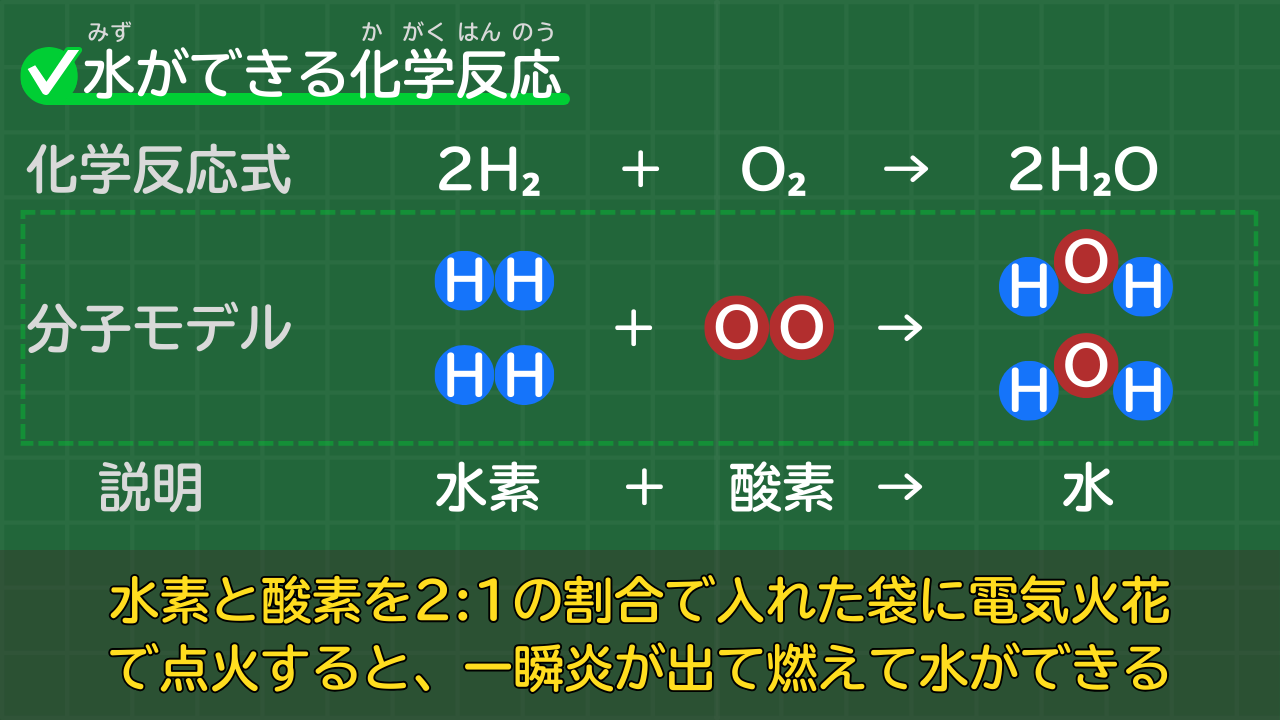
水素と酸素を、2:1の割合で入れた袋に電気火花で点火すると、一瞬炎が出て燃えて水ができます。
水ができる化学反応式は、次のとおりです。
水素と酸素から水ができる化学反応式
2H₂+O₂→2H₂O
(水素+酸素→水)
酸化【二酸化炭素ができる反応】C+O₂→CO₂
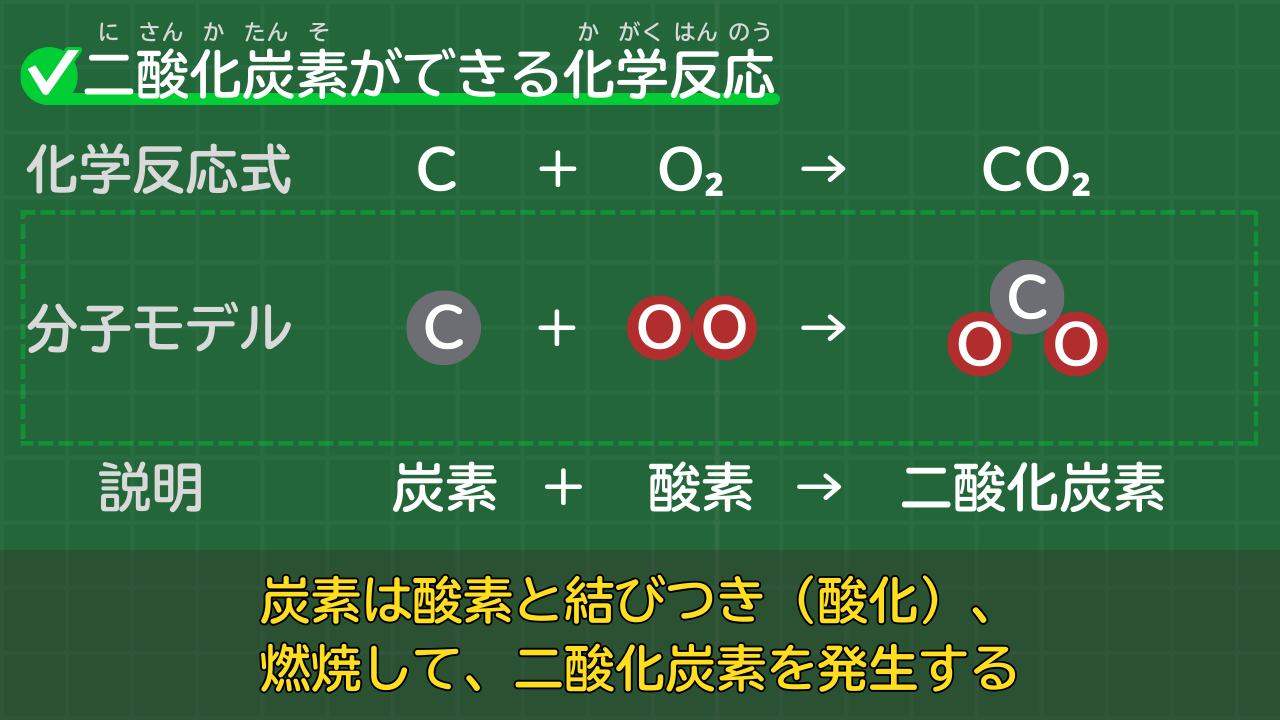
炭素は酸素と結びつき、二酸化炭素を発生させます。炭素を加熱すると赤くなり、高温になることから、燃焼が起きていることが分かります。
炭素と酸素から二酸化炭素ができる化学反応式は、次のとおりです。
炭素と酸素から二酸化炭素ができる化学反応式
C+O₂→CO₂
(炭素+酸素→二酸化炭素)
酸化【酸化銅ができる反応】2Cu+O₂→2CuO

銅は酸素と結びつき、酸化銅になります。このとき、銅は酸化されたと言えます。
銅と酸素から酸化銅ができる化学反応式は、次のとおりです。
銅と酸素から酸化銅ができる化学反応式
2Cu+O₂→2CuO
(銅+酸素→酸化銅)
酸化【マグネシウムの燃焼】2Mg+O₂→2MgO

マグネシウムは酸素と結びつき、酸化マグネシウムになります。このとき、マグネシウムは酸化されたと言えます。
マグネシウムと酸素から酸化マグネシウムができる化学反応式は、次のとおりです。
酸化マグネシウムができる化学反応式
2Mg+O₂→2MgO
(マグネシウム+酸素→酸化マグネシウム)
【塩化銅ができる反応】Cu+Cl₂→CuCl₂
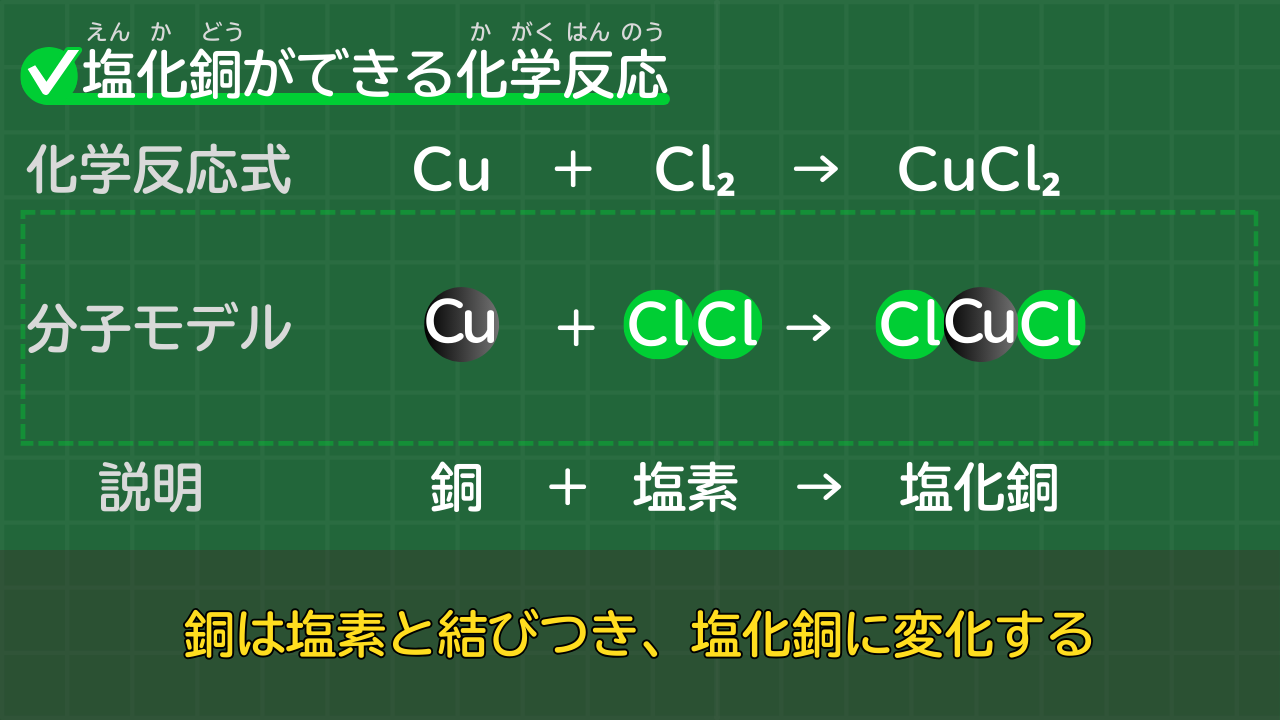
銅は塩素と結びつき、塩化銅になります。
銅と塩素から塩化銅ができる化学反応式は、次のとおりです。
塩化銅ができる化学反応式
Cu+Cl₂→CuCl₂
(銅+塩素→塩化銅)
【硫化鉄ができる反応】Fe+S→FeS

鉄は硫黄と結びつき、硫化鉄になります。
鉄と硫黄から硫化鉄ができる化学反応式は、次のとおりです。
硫化鉄ができる化学反応式
Fe+S→FeS
(鉄+硫黄→硫化鉄)
【硫化銅ができる反応】Cu+S→CuS

銅は硫黄と結びつき、硫化銅になります。
銅と硫黄から硫化銅ができる化学反応式は、次のとおりです。
硫化銅ができる化学反応式
Cu+S→CuS
(銅+硫黄→硫化銅)
還元の化学反応式一覧|中2理科 化学
中学2年の理科でよく出る、酸化と還元の化学反応式は次のとおりです。
酸化と還元の化学反応式一覧
- 酸化銅の炭素による還元
2CuO+C→2Cu+CO₂ - 酸化銅の水素による還元
CuO+H₂→Cu+H₂O - 二酸化炭素の還元
2Mg+CO₂→2MgO+C
酸素と結びつく化学変化を酸化、酸素とわかれる化学変化を還元といいます。酸化と還元は同時に起きます。
本章では、日本語版化学反応式や分子モデルを用いて分かりやすく解説します。
【酸化銅の炭素による還元】2CuO+C→2Cu+CO₂

酸化銅は酸素とわかれ、銅になります。この化学変化を還元といいます。
炭素は酸素と結びつき、二酸化炭素になります。この化学変化を酸化といいます。
なお、酸化と還元は同時に起きます。
酸化銅の炭素による還元の化学反応式は、次のとおりです。
酸化銅の炭素による還元の化学反応式
2CuO+C→2Cu+CO₂
(酸化銅+炭素→銅+二酸化炭素)
【酸化銅の水素による還元】CuO+H₂→Cu+H₂O
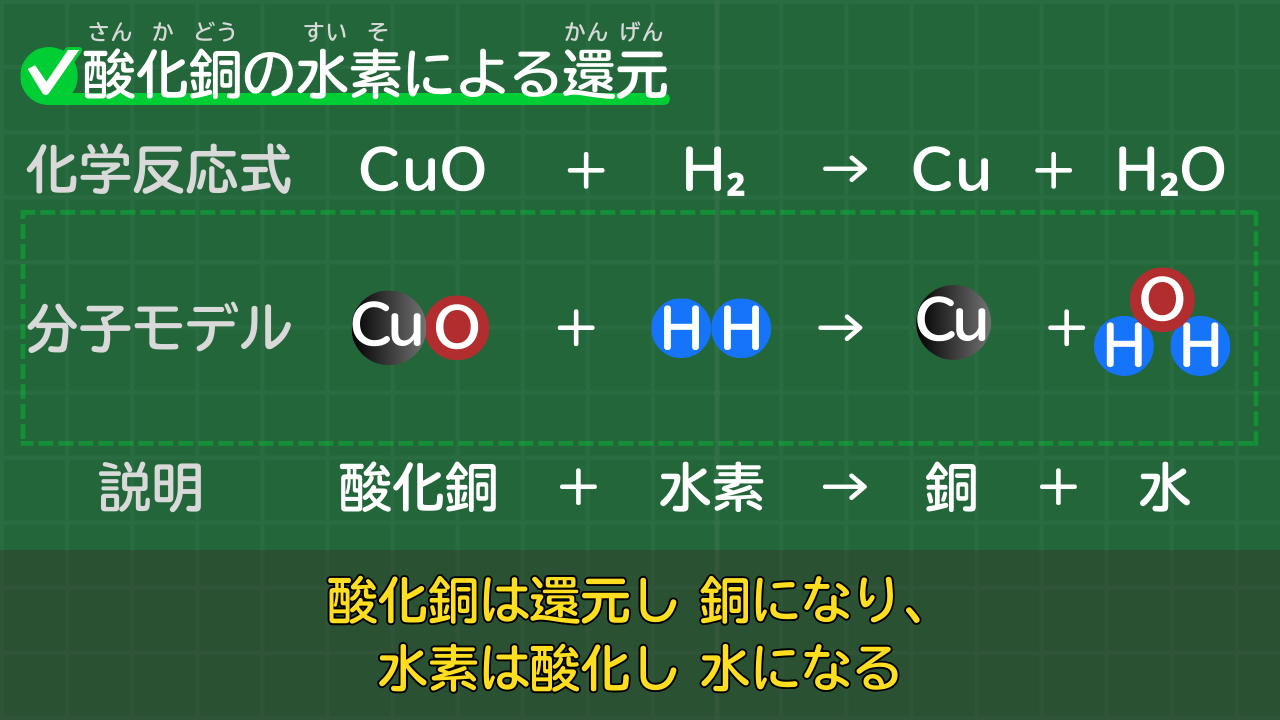
酸化銅は酸素とわかれ、銅になります。この化学変化を還元といいます。
水素は酸素と結びつき、水になります。この化学変化を酸化といいます。
なお、酸化と還元は同時に起きます。
酸化銅の水素による還元の化学反応式は、次のとおりです。
酸化銅の水素による還元の化学反応式
CuO+H₂→Cu+H₂O
(酸化銅+水素→銅+水)
【二酸化炭素の還元】2Mg+CO₂→2MgO+C
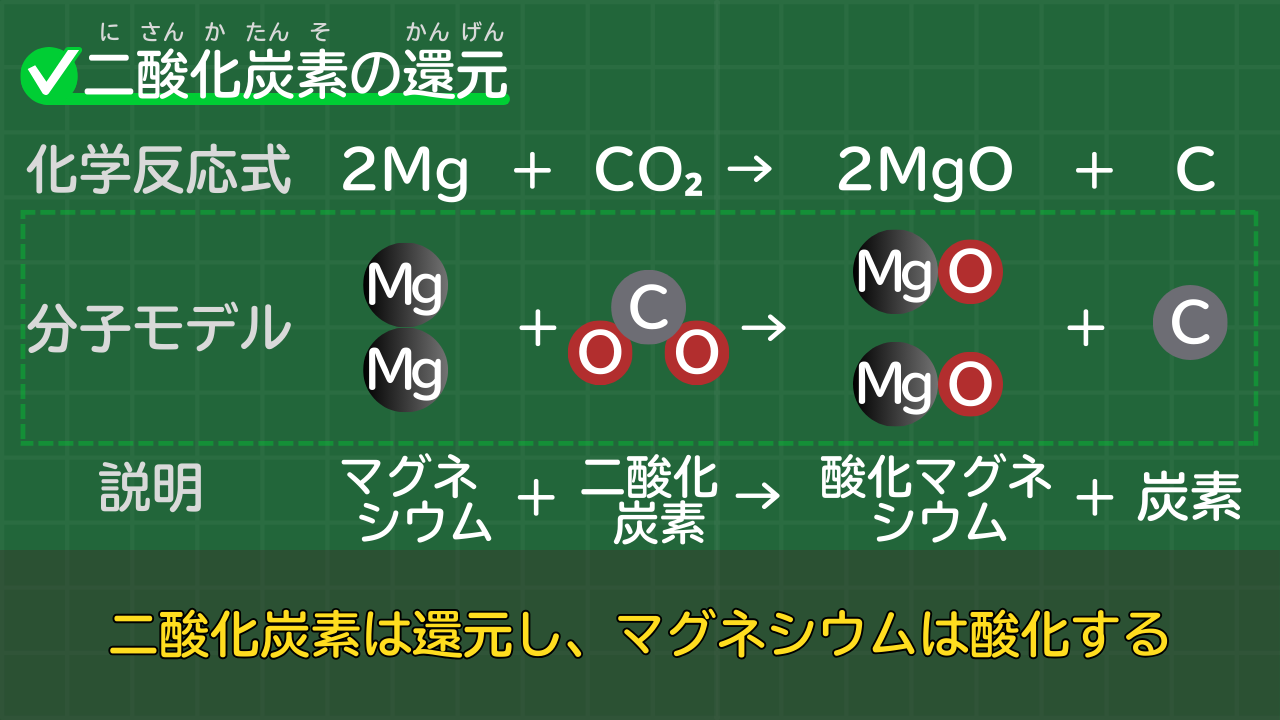
二酸化炭素は酸素とわかれ、炭素になります。この化学変化を還元といいます。
マグネシウムは酸素と結びつき、酸化マグネシウムになります。この化学変化を酸化といいます。
なお、酸化と還元は同時に起きます。
二酸化炭素のマグネシウムによる還元の化学反応式は、次のとおりです。
二酸化炭素の還元の化学反応式
2Mg+CO₂→2MgO+C
(マグネシウム+二酸化炭素→酸化マグネシウム+炭素)
質量保存の法則を確かめる実験
中学2年の理科で質量保存の法則を学習します。
質量保存の法則を確かめるために行う実験は、主に次の3つです。
質量保存の法則を確かめる実験
- 硫酸+水酸化バリウム→硫酸バリウム+水
- 塩酸+炭酸水素ナトリウム→塩化ナトリウム+水+二酸化炭素
- 銅+酸素→酸化銅
上記のうち、3.酸化銅ができる反応は前章で解説済みなので、1と2の反応を本章で解説します。
【硫酸バリウムの沈殿発生】H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
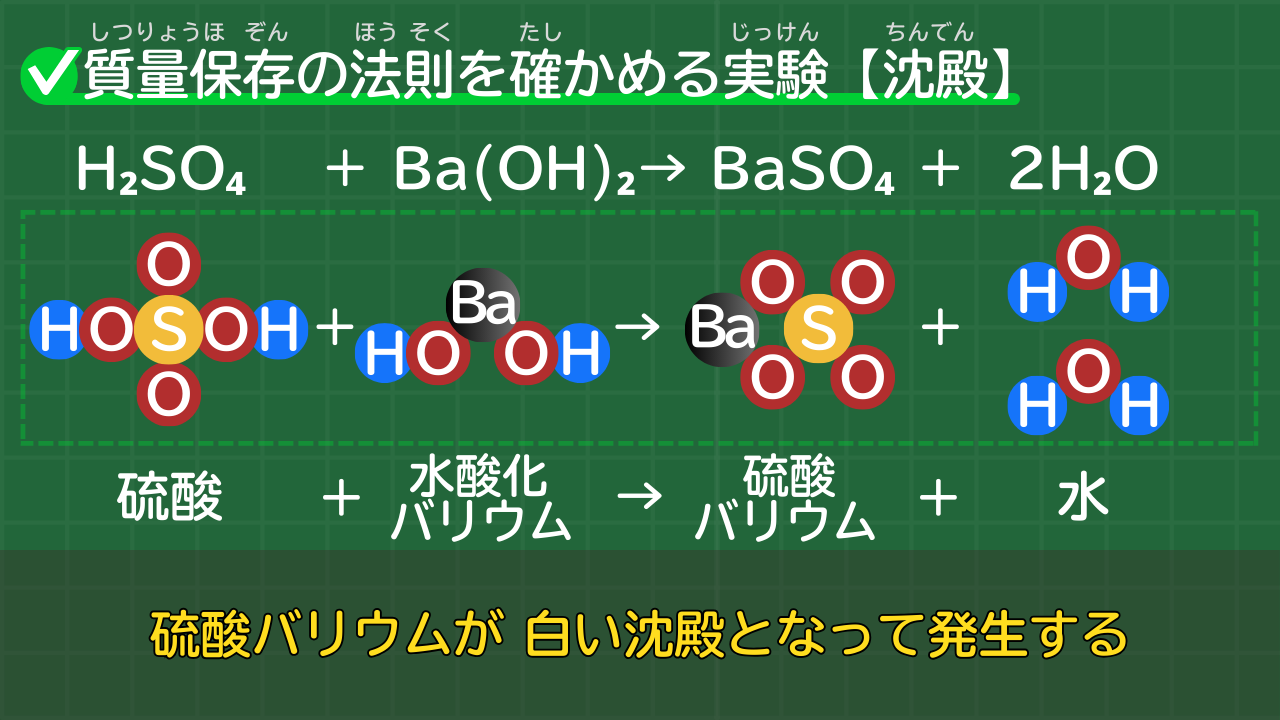
中学2年では、質量保存の法則を確かめる実験を学習します。
質量保存を確かめる実験のうち、白い沈殿が発生するタイプの実験が、硫酸と水酸化バリウムの反応です。
硫酸バリウムが生じる反応の化学反応式は、次のとおりです。
硫酸バリウムが生じる反応の化学反応式
H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
(硫酸+水酸化バリウム→硫酸バリウム+水)
【二酸化炭素の気体反応】HCl+NaHCO₃→NaCl+H₂O+CO₂
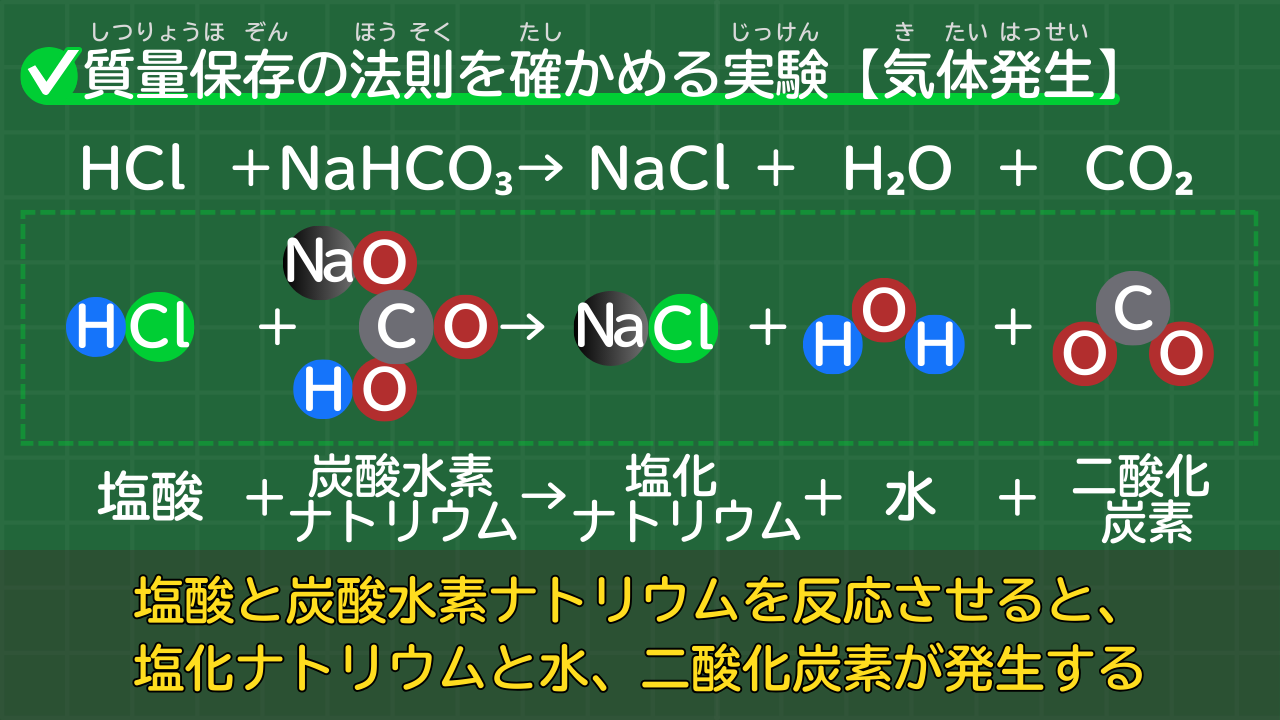
中学2年では、質量保存の法則を確かめる実験を学習します。
質量保存を確かめる実験のうち、気体が発生するタイプの実験が、塩酸と炭酸水素ナトリウムの反応です。
塩酸と炭酸水素ナトリウムの反応の化学反応式は、次のとおりです。
塩酸と炭酸水素ナトリウムの反応の化学反応式
HCl+NaHCO₃→NaCl+H₂O+CO₂
(塩酸+炭酸水素ナトリウム→塩化ナトリウム+水+二酸化炭素)
その他の化学反応式一覧|中2理科 化学
本章では、やや発展的な化学反応式を解説します。テストで高得点を狙いたい方や、難関私立の受験を考えている方は、参考にしてください。
本章で学べる内容
【応用】有機物の燃焼
【応用】アンモニアの発生
【参考】酸化鉄ができる反応
【発展】石灰石にうすい塩酸を加える反応
【発展】石灰水に二酸化炭素を通すと白くにごる反応
【発展】亜鉛にうすい塩酸を加えると水素が発生する
【応用】有機物の燃焼
有機物は燃えると二酸化炭素を発生します。
都市ガスの主成分であるメタンや、石油などの有機物は、燃えるときに大きな熱や激しい光を出します。
酸化するとき、激しく熱や光を出す現象を燃焼といいます。
例として、メタンの燃焼について考えましょう。
![]()
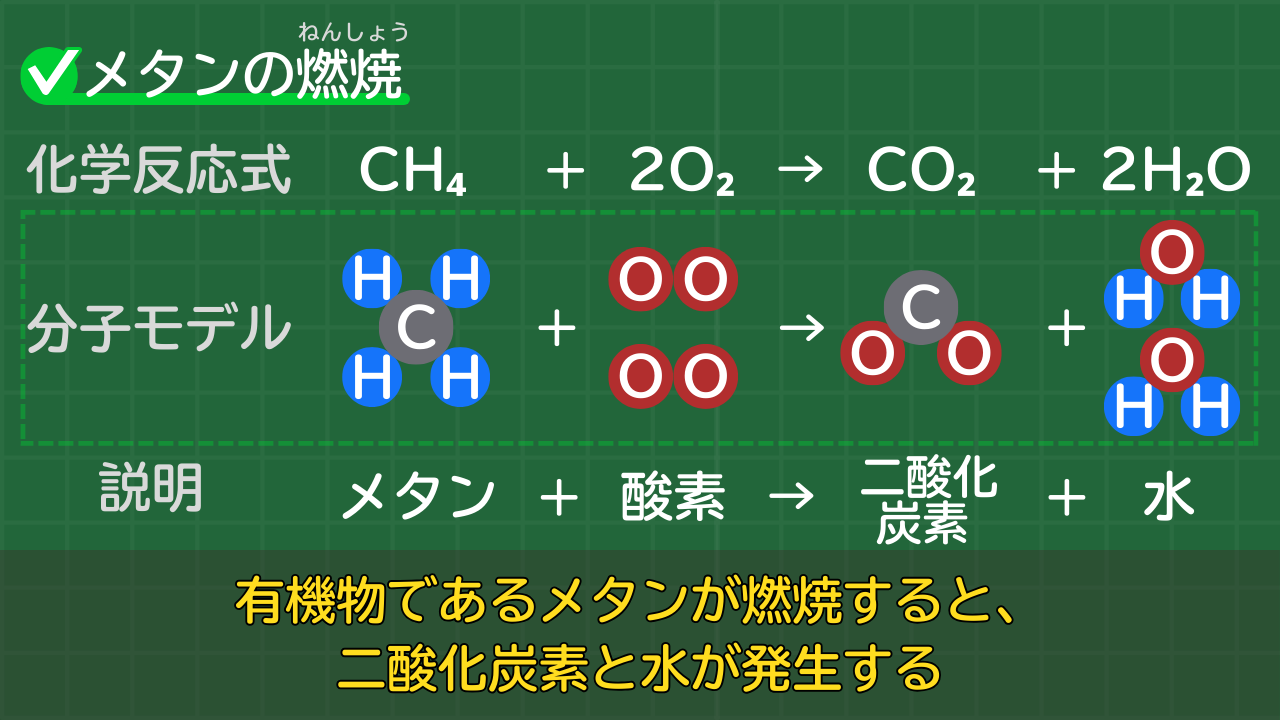
メタンの燃焼の化学反応式は、次のとおりです。
メタンの燃焼の化学反応式
CH₄+2O₂→CO₂+2H₂O
(メタン+酸素→二酸化炭素+水)
【応用】アンモニアの発生
アンモニアの発生は、中学理科では次のように、2度出てきます。
アンモニアの発生を学習する単元
- 中学1年の気体発生
- 中学2年の吸熱反応
アンモニアの発生の化学反応式は、やや難しいため、発展的な内容ですが、念のため覚えておくとよいでしょう。
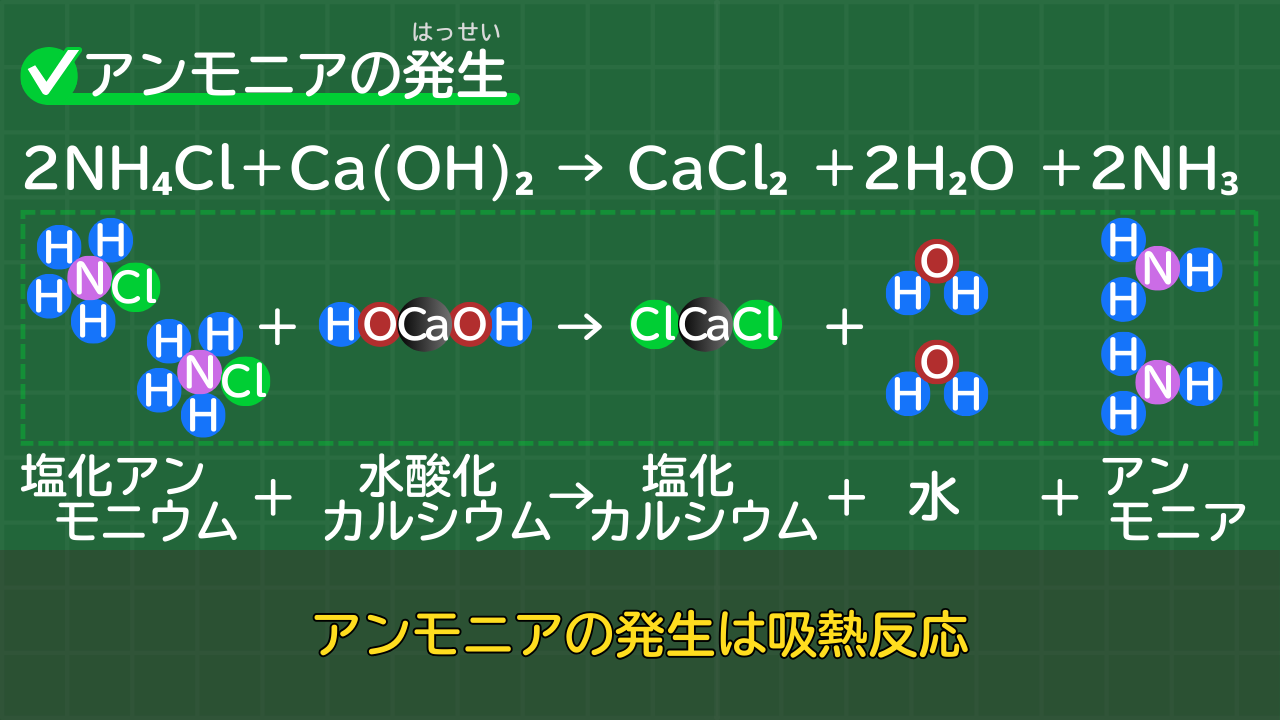
アンモニアの発生の化学反応式は、次のとおりです。
アンモニアの発生の化学反応式
2NH₄Cl+Ca(OH)₂→CaCl₂+2H₂O+2NH₃
(塩化アンモニウム+水酸化カルシウム→塩化カルシウム+水+アンモニア)
【参考】酸化鉄ができる反応
中学理科では、酸化鉄の化学式はあまり出題されません。実は酸化鉄には、化学式が主にFeO、Fe₂O₃のように、2種類あるからです。
FeOで表される酸化は酸化鉄(II)と言われています。

酸化鉄(II)ができる化学反応式は次のとおりです。
酸化鉄(II)ができる化学反応式
2Fe+O₂→2FeO
(鉄+酸素→酸化鉄)
【発展】石灰石にうすい塩酸を加える反応
中学1年では、二酸化炭素の発生実験を学習します。
二酸化炭素の発生には「石灰石にうすい塩酸を加える」という方法があります。
石灰石は、正式名称が「炭酸カルシウム」と言い、化学式がCaCO₃です。
「石灰石にうすい塩酸を加える」は、言い換えると「炭酸カルシウムにうすい塩酸を加える」となります。
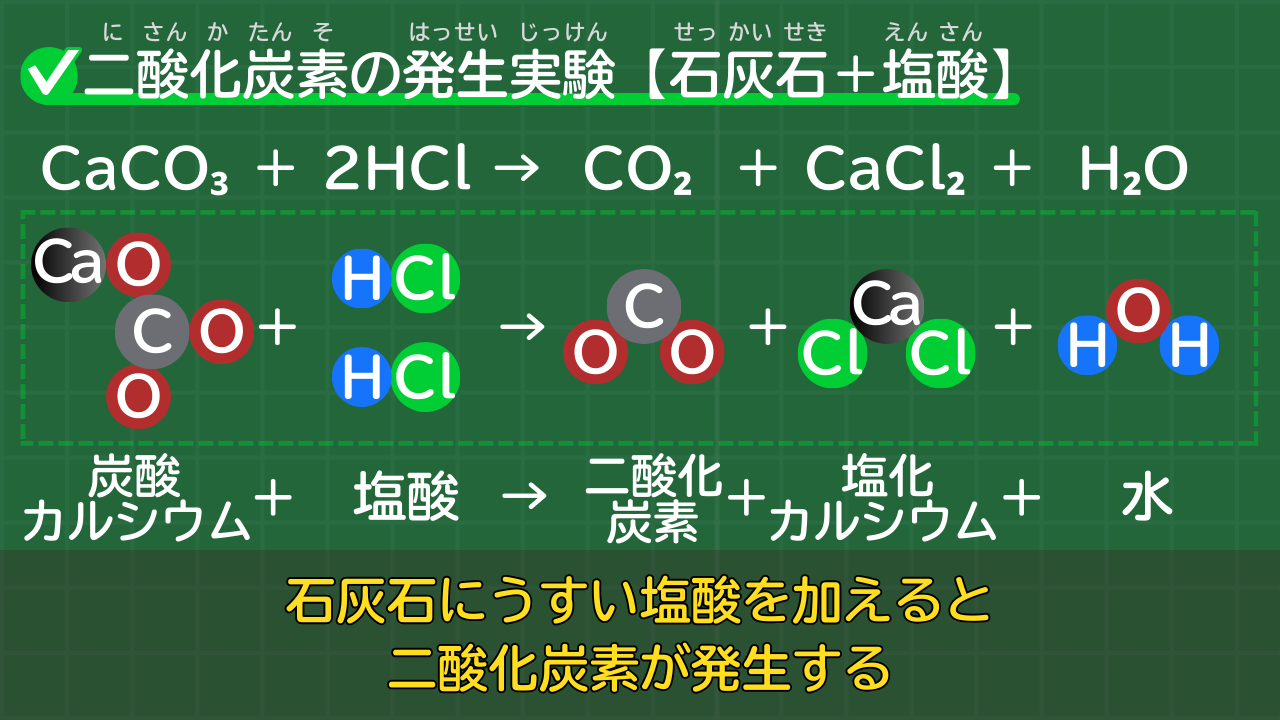
石灰石にうすい塩酸を加える反応の化学反応式は、次のとおりです。
石灰石にうすい塩酸を加える反応の化学反応式
CaCO₃+2HCl→CO₂+CaCl₂+H₂O
(炭酸カルシウム+塩酸→二酸化炭素+塩化カルシウム+水)
【発展】石灰水に二酸化炭素を通すと白くにごる反応
石灰水に二酸化炭素を通すと、白くにごります。この方法により、二酸化炭素の発生を確かめられます。
石灰水は、水酸化カルシウムを水に溶かしたものです。
水酸化カルシウムの化学式は、Ca(OH)₂です。
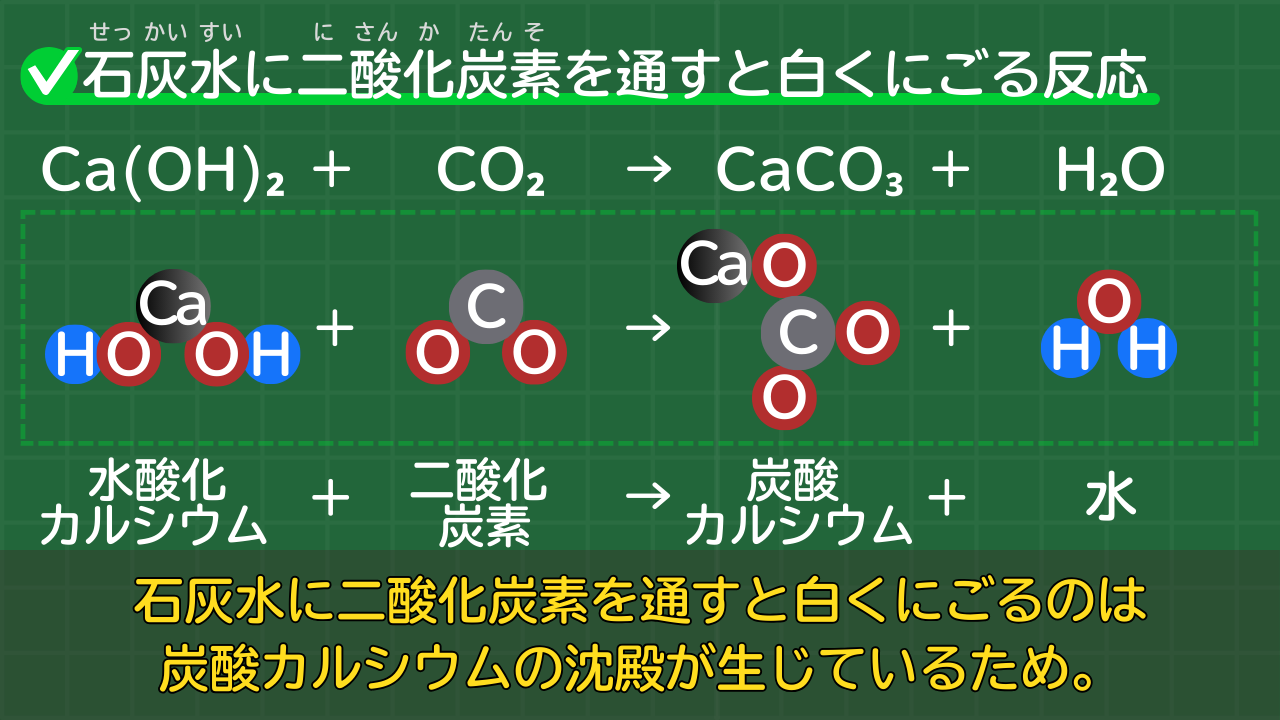
石灰水に二酸化炭素を通すと白くにごる反応の化学反応式は、次のとおりです。
水酸化カルシウムと二酸化炭素の反応の化学反応式
Ca(OH)₂+CO₂→CaCO₃+H₂O
(水酸化カルシウム+二酸化炭素→炭酸カルシウム+水)
【発展】亜鉛にうすい塩酸を加えると水素が発生する
中学1年では、水素の発生実験を学習します。
水素の発生には「亜鉛にうすい塩酸を加える」という方法があります。
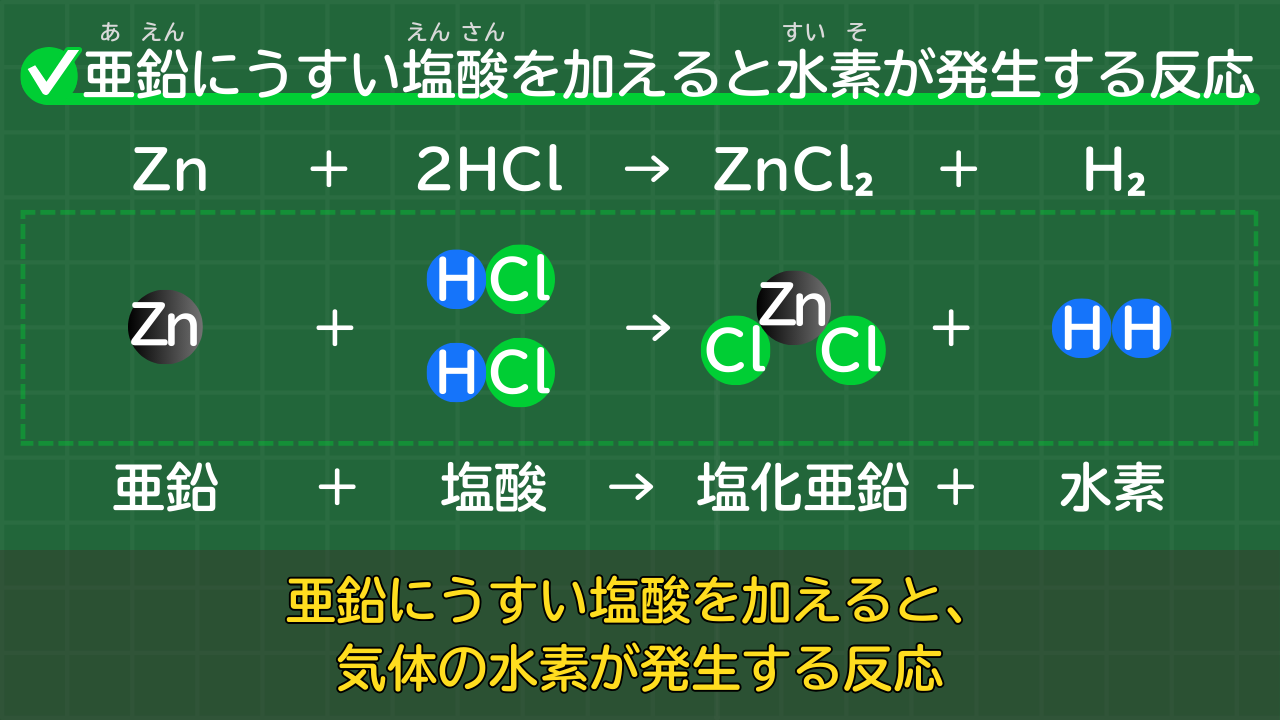
亜鉛にうすい塩酸を加えて、水素を発生させる反応の化学反応式は、次のとおりです。
亜鉛にうすい塩酸を加え、水素を発生させる反応の化学反応式
Zn+2HCl→ZnCl₂+H₂
(亜鉛+塩酸→塩化亜鉛+水素)
【まとめノート】化学反応式は書いて手で覚える|中2理科 化学
本記事では、高校入試や定期テストによく出る化学反応式を解説しました。
化学反応式をまとめたノートを参考にしてください(下図)▼
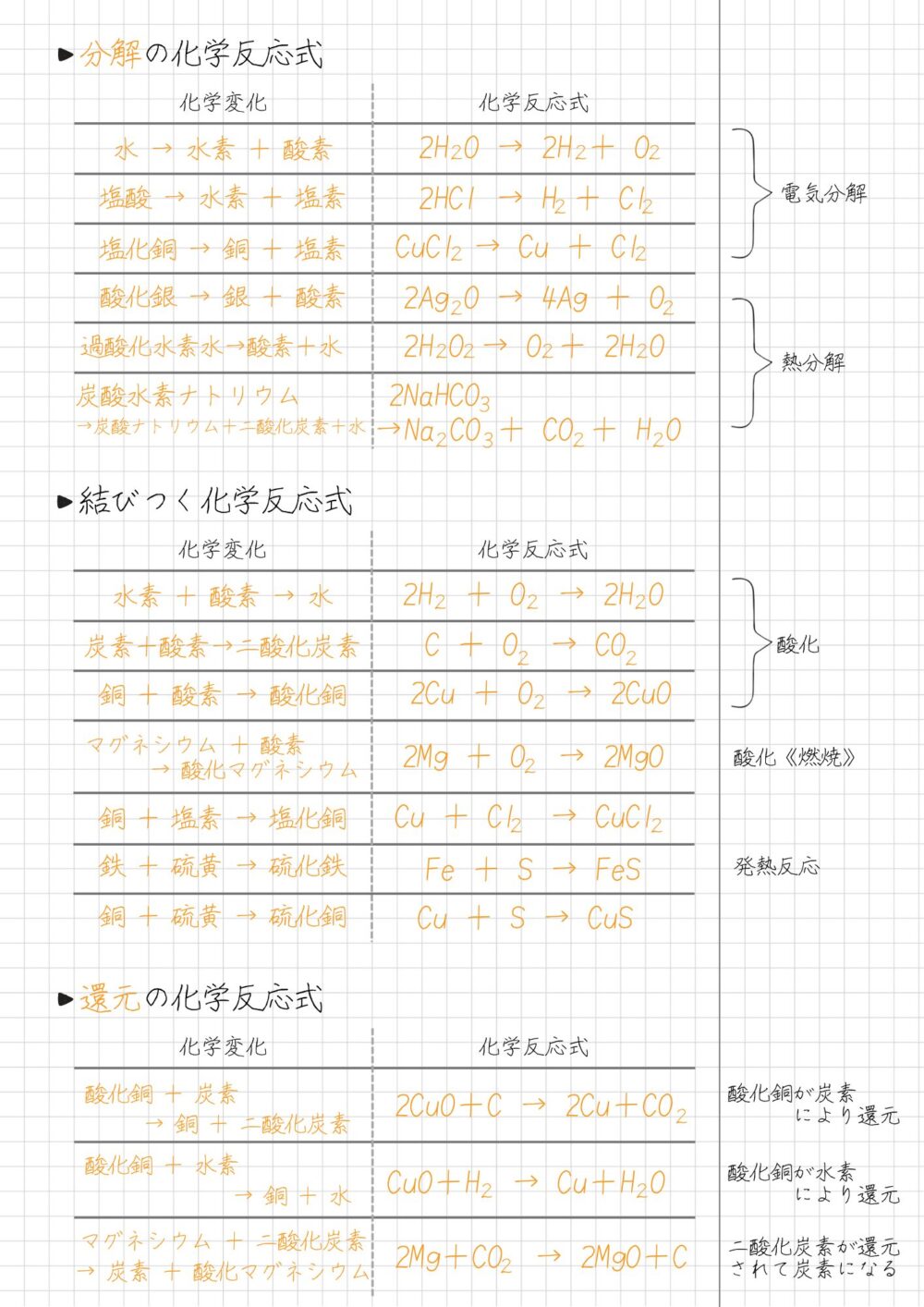
化学反応式は、テストで問われやすいため、何回も書いて、声に出して、暗唱して、五感をフル活用して覚えましょう。
化学反応式を書いた後は、矢印「→」の左右で、原子の数が等しいか必ず確かめましょう。
以上、中学2年生の化学分野『テストによく出る化学反応式の一覧』の解説でした。
原子と元素は、こちらから復習できます▼


化学式や分子は、次の記事も参考にしてください▼








